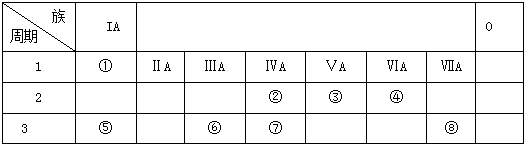
题目内容
(1)用0.1mol/L NaOH溶液分别中和pH和体积均相同的盐酸和醋酸,消耗NaOH溶液的体积较多的是 .
(2)已知NaHCO3水溶液呈碱性,则其溶液中五种离子的浓度由大到小的顺序是(用规范的浓度符号回答) .
(2)已知NaHCO3水溶液呈碱性,则其溶液中五种离子的浓度由大到小的顺序是(用规范的浓度符号回答)
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)醋酸是弱酸,不能完全电离,pH和体积均相同的盐酸和醋酸,醋酸的浓度大;
(2)钠离子不水解,碳酸氢根离子水解,碳酸氢钠溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,但水解是微弱的,根据离子的来源确定氢离子浓度和碳酸根离子浓度的相对大小.
(2)钠离子不水解,碳酸氢根离子水解,碳酸氢钠溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,但水解是微弱的,根据离子的来源确定氢离子浓度和碳酸根离子浓度的相对大小.
解答:
解:(1)醋酸是弱酸,不能完全电离,pH和体积均相同的盐酸和醋酸,醋酸的浓度大,体积相同的盐酸和醋酸,醋酸的物质的量大,所以消耗NaOH溶液的体积较多,故答案为:醋酸;
(2)钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c(HCO3-),碳酸氢钠水解而使溶液呈碱性,所以c(OH-)>c(H+),但水解是微弱的,溶液中阴离子主要以碳酸氢根离子存在,所以c(HCO3-)>c(OH-),溶液中碳酸氢根离子电离出氢离子和碳酸根离子、水电离出氢离子,所以c(H+)>c(CO32-),故溶液中各种离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(2)钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c(HCO3-),碳酸氢钠水解而使溶液呈碱性,所以c(OH-)>c(H+),但水解是微弱的,溶液中阴离子主要以碳酸氢根离子存在,所以c(HCO3-)>c(OH-),溶液中碳酸氢根离子电离出氢离子和碳酸根离子、水电离出氢离子,所以c(H+)>c(CO32-),故溶液中各种离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
点评:本题涉及弱电解质的电离以及溶液中离子浓度浓度的大小关系比较知识,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、标准标况下,22.4L水所含的分子数目为6.02×1023个 |
| B、2g氢气所含氢原子数目为2×6.02×1023个 |
| C、500ml2mol?L-1的Ba(NO3)2溶液中含NO3-离子数为2×6.02×1023个 |
| D、0.5mol氯气分子中含Cl原子数为6.02×1023个 |
在配制一定物质的量浓度的硫酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、定容时仰视容量瓶瓶颈刻度线 |
| D、摇匀后见液面下降,再加水至刻度线 |
下列实验操作中正确的是( )
| A、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
B、右图能用作防倒吸装置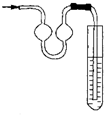 |
| C、蒸馏时,通过冷凝管冷凝得到的液体直接用锥形瓶接收 |
| D、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
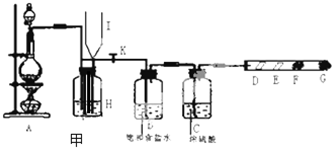
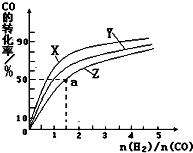 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.