题目内容
火电厂的燃煤烟气中含有SO2,现有5.6×104m3的燃煤烟气中,SO2的含量为0.2%,利用生石灰吸收SO2经一系列反应可以得到石膏(CaSO4?2H2O) kg.
考点:化学方程式的有关计算
专题:计算题
分析:根据反应方程式2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4?2H2O)计算.
解答:
解:SO2和石灰乳和氧气反应的总方程式为:
2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4?2H2O)
2×22.4 m3 2×196kg
5.6×104m3 ×0.2% m
m=
=980kg,
故答案为:980.
2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4?2H2O)
2×22.4 m3 2×196kg
5.6×104m3 ×0.2% m
m=
| 5.6×104m3×0.2%×2×196kg |
| 2×22.4m3 |
故答案为:980.
点评:本题考查了化学方程式得出计算,中等难度,计算时要注意单位的对应.

练习册系列答案
相关题目
下列变化需要加入还原剂才能实现的转化是( )
| A、浓H2SO4→SO2 |
| B、Fe2+→Fe3+ |
| C、H2S→SO2 |
| D、HCO3-→CO2 |
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O.当有1mol H2O参与反应时,转移电子的物质的量为( )
| A、0.5 mol |
| B、1 mol |
| C、2 mol |
| D、4 mol |
在一定条件下,钠与O2反应可生成1.5g固体,若将相同质量的钠与80mL 0.50mol/L的盐酸反应,钠恰好完全转化生成NaCl,则1.5g固体的成分是( )
| A、Na2O |
| B、Na2O2 |
| C、Na2O和Na2O2 |
| D、Na2O2和NaO2 |
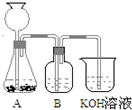 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验: