题目内容
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
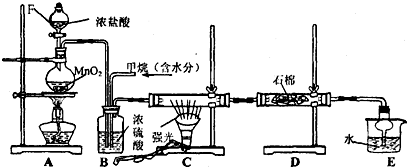
根据要求填空:
(1)实验室制取Cl2的化学反应方程式为: .
(2)写出CH4与Cl2生成一氯代物的化学反应方程式 .
(3)B装置有三种功能:①干燥气体;②将气体混合均匀;③ .
(4)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是 .
(5)E装置的作用是 (填编号);
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 .

根据要求填空:
(1)实验室制取Cl2的化学反应方程式为:
(2)写出CH4与Cl2生成一氯代物的化学反应方程式
(3)B装置有三种功能:①干燥气体;②将气体混合均匀;③
(4)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是
(5)E装置的作用是
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)MnO2能将HCl(浓)氧化为Cl2;
(2)甲烷可以和氯气放生取代反应;
(3)浓硫酸可以控制气体流速;
(4)氯气能将碘化钾氧化为碘单质;
(5)反应后剩余的氯化氢气体能够污染空气,不能排放到空气中,需要吸收,氯化氢易溶于水需要放倒吸;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
(2)甲烷可以和氯气放生取代反应;
(3)浓硫酸可以控制气体流速;
(4)氯气能将碘化钾氧化为碘单质;
(5)反应后剩余的氯化氢气体能够污染空气,不能排放到空气中,需要吸收,氯化氢易溶于水需要放倒吸;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
解答:
解:(1)MnO2和HCl(浓)在加热时生成MnCl2和Cl2、H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)甲烷与氯气反应生成一氯甲烷的方程式为:CH4+Cl2
CH3Cl+HCl,故答案为:CH4+Cl2
CH3Cl+HCl;
(3)通过气泡的多少来控制气体的流速,故答案为:控制气体流速;
(4)氯气能将碘化钾氧化为碘单质,KI饱和溶液及KI粉末可除去过量的氯气,故答案为:除去过量的氯气;
(5)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:CD;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
故答案为:分液.
| ||
(2)甲烷与氯气反应生成一氯甲烷的方程式为:CH4+Cl2
| 光照 |
| 光照 |
(3)通过气泡的多少来控制气体的流速,故答案为:控制气体流速;
(4)氯气能将碘化钾氧化为碘单质,KI饱和溶液及KI粉末可除去过量的氯气,故答案为:除去过量的氯气;
(5)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:CD;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
故答案为:分液.
点评:本题考查甲烷和氯气的取代反应、氯气的实验室制法,可以根据所学知识进行回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于有机物的说法错误的是( )
| A、CCl4可由CH4制得,可萃取碘水中的碘 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
| D、苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
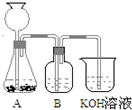 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
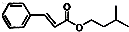 )的路线如下:
)的路线如下: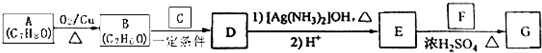
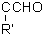 +H2O.
+H2O.