题目内容
4.下列物质碱性最强的是( )| A. | LiOH | B. | KOH | C. | RbOH | D. | NaOH |
分析 同周期元素从左向右金属性在减弱,同主族元素从上到下金属性增强;金属性越强,对应的最高价氧化物的水化物的碱性越强;
解答 解:Li、Na、K、Cs属于同主族金属元素,同主族元素从上到下金属性逐渐增强,即金属性Li<Na<K<Cs;金属性越强,金属性越强,对应的最高价氧化物的水化物的碱性越强,所以碱性最强的为CsOH,其次是RbOH,
故选C.
点评 本题考查元素周期律,明确同周期、同主族元素性质的变化规律即可解答,难度不大,注重基础知识的考查.

练习册系列答案
相关题目
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
19.有关钴和铁化合物的性质见下表.用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑,工艺流程如下,试回答:
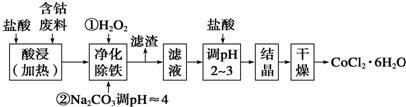
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH-.
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.

| 物质 | 溶度积Ksp | 沉淀完全时的pH |
| Co(OH)2 | 5.9×10-15 | 9.4 |
| Fe(OH)2 | 1.6×10-14 | 9.6 |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
(2)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
(3)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)滤液的主要成分是CoCl2、NaCl、HCl.
(5)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
9.下列气体属于无色、无味、有毒的气体是( )
| A. | CO | B. | SO2 | C. | CO2 | D. | H2S |
16.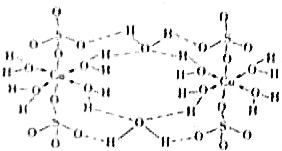 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
10.某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述中正确的( )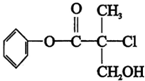

| A. | 有机物A属于芳香烃 | |
| B. | 有机物A可以和Br的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A可与NaOH溶液反应,生成多种可溶于水的化合物 |
 和
和  D、35Cl和37Cl
D、35Cl和37Cl
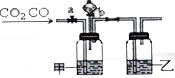 某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).
某学生用如图装置进行CO和CO2混合气体的分离和干燥.其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否).