题目内容
5.已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,M为红褐色固体.回答相关问题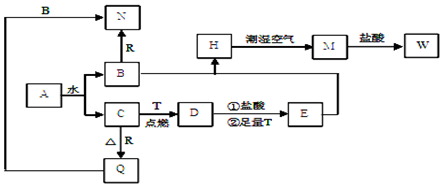
(1)写出D的化学式:Fe3O4
(2)写出A的电子式:

(3)H在潮湿空气中变为M的现象是:白色沉淀变化为灰绿色最后变化为红褐色化学方程式为:4 Fe(OH)2+O2+2H2O═4 Fe(OH)3
(4)B与R反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(5)向沸水中加入W饱和溶液,可制得一种红褐色透明液体,区别该液体和溶液W的简单实验方法是丁达尔效应,将一束光射向该液体,从侧面观察看到一条光亮的通路.
分析 A为淡黄色固体,且A能和水反应,则A是Na2O2,A和水反应生成NaOH和O2,C是无色无味的气体,则C是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,Fe在氧气中燃烧生成四氧化三铁,则T是Fe,R和氧气反应生成氧化物Q,Q能和NaOH溶液反应,则Q是Al2O3、R是Al,N是NaAlO2,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M,则H是Fe(OH)2、M是Fe(OH)3,Fe3O4和HCl、Fe反应后得到E,E为FeCl2,Fe(OH)3和HCl反应生成W,则W是FeCl3,再结合问题分析解答.
解答 解:A为淡黄色固体,且A能和水反应,则A是Na2O2,A和水反应生成NaOH和O2,C是无色无味的气体,则C是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,Fe在氧气中燃烧生成四氧化三铁,则T是Fe,R和氧气反应生成氧化物Q,Q能和NaOH溶液反应,则Q是Al2O3、R是Al,N是NaAlO2,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M,则H是Fe(OH)2、M是Fe(OH)3,Fe3O4和HCl、Fe反应后得到E,E为FeCl2,Fe(OH)3和HCl反应生成W,则W是FeCl3,
(1)通过以上分析知,D是Fe3O4,
故答案为:Fe3O4;
(2)分析可知A为过氧化钠,电子式为 ,故答案为:
,故答案为: ;
;
(3)H是Fe(OH)2,Fe(OH)2不稳定,易被空气氧化生成Fe(OH)3,白色沉淀变化为灰绿色最后变化为红褐色,反应方程式为4 Fe(OH)2+O2+2H2O═4 Fe(OH)3,
故答案为:白色沉淀变化为灰绿色最后变化为红褐色;4 Fe(OH)2+O2+2H2O═4 Fe(OH)3;
(4)铝和NaOH溶液反应生成偏铝酸钠和氢气,化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)向沸水中加入FeCl3饱和溶液,可制得一种红褐色液体,该液体是胶体,可以利用丁达尔现象来证明,实验证明方法是将一束光射向该液体,从侧面观察看到一条光亮的通路,
故答案为:丁达尔效应,将一束光射向该液体,从侧面观察看到一条光亮的通路.
点评 本题以Na、Al、Fe及其化合物为载体考查了金属元素及其化合物的推断,根据H的颜色变化、A的颜色及性质、D的性质为突破口采用正逆结合的方法进行推断,熟悉物质性质是解本题关键,再结合物质间的转化来解答,题目难度中等.

| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
| A. | 盐中一定含有金属元素 | B. | 氢化物一定是共价化合物 | ||
| C. | 碱中一定含有氢、氧元素 | D. | 能电离出H+的物质一定是酸 |
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |