题目内容
17.写出下列典型物质的电离方程式(1)H2SO4H2SO4=2H++SO42-;
(2)CH3COOHCH3COOH?H++CH3COO-.
(3)NH3•H2ONH3•H2O?NH4++OH-;
(4)Fe(OH)3Fe(OH)3?Fe3++3OH-;
(5)NaHCO3NaHCO3═Na++HCO3-;
(6)NaHSO4NaHSO4=Na++H++SO42-.
分析 先判断强弱电解质,强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号,据此进行解答.
解答 解:(1)硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为:CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
(3)NH3•H2O为弱电解质,在溶液中部分电离,其电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)Fe(OH)3为三元弱碱,部分电离,用可逆符号,多元弱碱,只需一步书写,电离出Fe3+、OH-,其电离方程式为:Fe(OH)3?Fe3++3OH-;
故答案为:Fe(OH)3?Fe3++3OH-;
(5)NaHCO3是H2CO3的酸式盐,属强电解质,完全电离用“═”,HCO3-不能拆,其电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(6)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离用“═”,电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查了电离方程式的书写方法,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
7.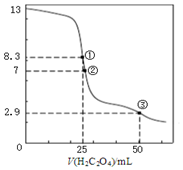 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
12.能说明醋酸是弱电解质的事实是( )
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| C. | 醋酸钠溶液呈一定的碱性 | |
| D. | 0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L |
2.铁及其化合物在工农业生产中有重要的作用.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.
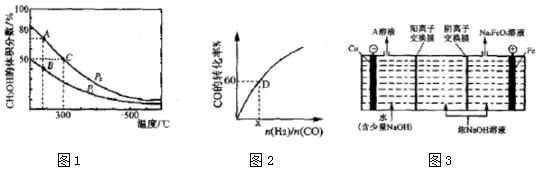
①在图1A、B、C三点中,选填表物理量对应最大的点.
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,该反应向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.

①在图1A、B、C三点中,选填表物理量对应最大的点.
| 反应速率v | 平衡常数K | 平衡转化率α |
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
9.化学与生活、材料等密切相关,下列说法错误的是( )
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
6.X、Y、Z、W为短周期元素,X2-和Y+核外电子排布相同,X、Z位于同一主族,Z、W位于同一周期,W的最外层电子数是X、Y最外层电子数之和.下列说法不正确的是( )
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |