题目内容
7.已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z.元素Y、X、Z对应原子的原子核中质子数依次递增.
②X在A、B、C、D中都不呈现它的最高化合价.
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.
④化合物D受热催化分解,可制得元素Y的单质.
(1)元素X是Cl,Z是K.
(2)写出③中反应的化学方程式:Cl2+2KOH=KCl+KClO+H2O.
(3)写出④中反应的化学方程式:2KClO3$\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑.
分析 室温下单质A与某种常见一元强碱溶液反应,可得到B和C,且A、B、C中都含有X,说明A中元素在碱中发生了歧化反应,常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等,一定条件下化合物D受热分解生成B,可制得元素Y的单质,可知应为KClO3分解,由此可知X为氯元素,Y为氧元素,Z为K元素,A为Cl2,D为KClO3,B为KCl,C为KClO,验证符合,据此解答.
解答 解:室温下单质A与某种常见一元强碱溶液反应,可得到B和C,且A、B、C中都含有X,说明A中元素在碱中发生了歧化反应,常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等,一定条件下化合物D受热分解生成B,可制得元素Y的单质,可知应为KClO3分解,由此可知X为氯元素,Y为氧元素,Z为K元素,A为Cl2,D为KClO3,B为KCl,C为KClO,验证符合,
(1)X为氯元素,Y为氧元素,Z为K元素,故答案为:Cl;K;
(2)③中氯气与氢氧化钾反应,生成氯化钾、次氯酸钾和水,反应的化学方程式为:Cl2+2KOH=KCl+KClO+H2O,
故答案为:Cl2+2KOH=KCl+KClO+H2O;
(3)④中氯酸钾分解生成氯化钾和氧气,反应方程式为2KClO3$\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑,故答案为:2KClO3$\frac{\underline{\;二氧化锰\;}}{△}$2KCl+3O2↑.
点评 本题考查元素化合物推断,需要学生熟练掌握元素化合物性质,综合题中信息,进行猜测,再顺推、逆推和逐个验证,难度中等.

练习册系列答案
相关题目
8.下列不属于食盐用途的是( )
| A. | 调味剂 | B. | 营养增强剂 | C. | 着色剂 | D. | 防腐剂 |
5.类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论.因此,推出的结论最终要经过实践的检验才能决定其是否正确.以下几种类推结论中,正确的是( )
| A. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 氯最高价氧化物对应的水化物为HClO4;则氟最高价氧化物对应的水化物HFO4 | |
| D. | NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性 |
2.表为元素周期表的一部分.
回答下列问题:
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为-69℃和58℃,写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为NO、NO2,物质的量分别为1.3mol、0.9mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为-69℃和58℃,写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为NO、NO2,物质的量分别为1.3mol、0.9mol,生成硫酸铜物质的量为2mol.
19.关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等.其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ①② |
17.下列数据是对应物质的熔点表,有关的判断正确的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要由金属元素和非金属元素形成的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8个电子的稳定结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |
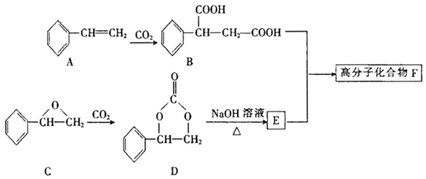
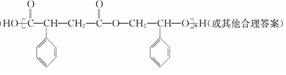
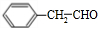 ,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为
,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为