题目内容
19.关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等.其中正确的是( )| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ①② |
分析 同温同压下等体积的CO2和CO的物质的量相同,则分子数相等,碳原子个数相等,根据物质的量和相对分子质量计算质量关系和密度关系.
解答 解:根据阿伏加德罗定律可知:同温同压下等体积的CO2和CO的物质的量相同,则分子数相等,碳原子个数相等,
CO2和CO的相对分子质量不同,相同物质的量时,二者质量不同,
密度等于质量除以体积,质量不同,体积相同,则密度不同,
所以二者具有相等的分子数以及所含碳原子数,
故选C.
点评 本题考查物质的量的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
| A. | 该溶液中可能含K+ | |
| B. | 该溶液中肯定含有NO3-、SO42-、NH4+、CO32- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1mol/L |
20.下列分子或离子的中心原子杂化轨道的类型相同的是( )
| A. | SO32-与SO3 | B. | CH4与H2O | C. | NCl3与BF3 | D. | SO32-与CO32- |
8.下列根据实验现象所得出的结论中,正确的是( )
| A. | 向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- | |
| B. | 向无色溶液加入盐酸有气体产生,结论:溶液中有CO32- | |
| C. | 向无色试液加入硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- | |
| D. | 向某溶液中加入氢氧化钠溶液加热,有氨气生成,结论:溶液中含有NH4+ |
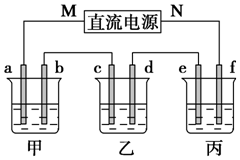 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.