题目内容
8.下列反应的离子方程式正确的是( )| A. | 碳酸钙溶于醋酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯化铁溶液溶解铜 Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 氯气溶于水 Cl2+H2O═2H++Cl-+ClO- | |
| D. | 氢氧化钠溶液吸收二氧化硫气体 SO2+2OH-═SO42-+H2O |
分析 A.醋酸为弱酸,保留化学式;
B..二者反应生成氯化亚铁和氯化铜;
C.次氯酸为弱酸,应保留化学式;
D.原子个数不守恒;
解答 解:A.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故A错误;
B.氯化铁溶液溶解铜,离子方程式:Cu+2Fe3+═Cu2++2Fe2+,故B正确;
C.氯气溶于水,离子方程式:Cl2+H2O═H++Cl-+HClO,故C错误;
D.氢氧化钠溶液吸收二氧化硫气体,反应生成亚硫酸钠和水,离子方程式:SO2+2OH-═SO32-+H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分.

练习册系列答案
相关题目
19.下列装置中能组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  |
3.有关原电池的说法正确的是( )
| A. | “Cu-Zn-硫酸”原电池中,电子从Zn经过导线到达Cu,再经过溶液回到Zn形成闭合回路 | |
| B. | “Al-Mg-NaOH”原电池中,活泼型强的Mg失去电子,被氧化,做负极 | |
| C. | 理论上所有自发进行的氧化还原反应均可设计成原电池 | |
| D. | 已知铅蓄电池总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,可推负极是反应是 Pb-2e-=Pb2+ |
13.下列物质中存在离子键和非极性键的是( )
| A. | NaOH | B. | NH4Cl | C. | CaC2 | D. | H2O2 |
20.乳酸在一定条件下所形成的聚酯的结构简式为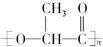 ,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
 ,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )| A. | 降解塑料是一种纯净物 | |
| B. | 其生产过程中的聚合方式与聚苯乙烯相似 | |
| C. | 它属于一种线型高分子材料 | |
| D. | 其相对分子质量为72 |
18.下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A. | 16 g O2所含的原子数目为NA | |
| B. | 0.5 mol H2O2含有的原子数目为1.5NA | |
| C. | 1 mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5 mol |
 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是 .
.