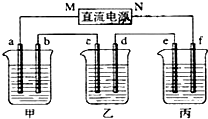
题目内容
9. 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
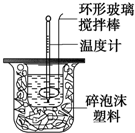
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
分析 (1)根据酸碱中和热书写热化学方程式;
(2)硫酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使硫酸与NaOH溶液混合均匀;
(3)①先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
②a.装置保温、隔热效果差,测得的热量偏小;
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小;
c.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小;
d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失.
解答 解:(1)中和热是在稀溶液中,强酸与强碱反应生成1mol水的热效应,中和反应一定放热,△H<0,根据题中的中和热的数值为57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,
故选:D;
(3)①3次温度差分别为:3.4℃,3.3℃,3.5℃,均有效,温度差平均值=3.4℃;50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol;中和热为:△H=-56.8kJ/mol,
故答案为:3.4℃;-56.8kJ/mol;
②a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故b正确;
c.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故c正确;
d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故d正确;
故答案为:abcd.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 | |
| D. | 吸热反应在常温条件下一定不会发生 |
①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均摩尔质量不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时生成n mol D.
| A. | ①②③ | B. | ③②⑤ | C. | ②③⑤⑥ | D. | ①②⑤⑥ |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的某一位置.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至溶液刚好变色,测得盐酸的体积为V1mL.
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是未用标准液润洗酸式滴定管由此造成的测定结果偏高(偏高、偏低或无影响)
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| A. | CH3CH2Cl与CH3CH2CH2Br | B. |  与 与 | ||
| C. | 乙酸与HCOOCH3 | D. | CH3CH2CH2OH与CH3OH |
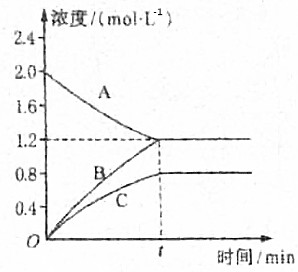 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答: