题目内容
(1)氨基酸是蛋白质的基石,氮基酸分子中的氨基(-NH2)显碱性.氢基酸往往形成一种两性离子,在水溶液中存在如下平衡:

方框内所表示的离子(1)的结构简式是 .
(2)谷氨酸的一钠盐( )是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.
)是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.
①淀粉发生水解反应的化学方程式是 .
②实验室中检验淀粉水解产物应选用的试剂是 (填字母).
a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、氨水、AgNO3溶液
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛酶定法”用于测定味精中谷氨酸一钠盐的含量.将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为-NH2+HCHO→-N=CH2+H2O再以酚酞为指示剂,用NaOH溶液进行滴定.上述测定过程中加入甲醛的目的是 .
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、 (填缺少的步骤),称量沉淀质量,重复实验3次.
②乙方案:已知AgSCN是难溶于水的沉淀a取m g味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量 (填可能的化学式)溶液作指示剂,用浓度为c2 mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是 .

方框内所表示的离子(1)的结构简式是
(2)谷氨酸的一钠盐(
 )是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.
)是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.①淀粉发生水解反应的化学方程式是
②实验室中检验淀粉水解产物应选用的试剂是
a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、氨水、AgNO3溶液
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛酶定法”用于测定味精中谷氨酸一钠盐的含量.将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为-NH2+HCHO→-N=CH2+H2O再以酚酞为指示剂,用NaOH溶液进行滴定.上述测定过程中加入甲醛的目的是
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、
②乙方案:已知AgSCN是难溶于水的沉淀a取m g味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量
考点:人体必需的氨基酸,化学方程式的有关计算
专题:
分析:(1)羧基能与氢氧根反应;
(2)①淀粉发生水解生成葡萄糖,据此写化学方程式;
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,再通过检验葡萄糖中的醛基证明产物,据此答题;
(3)加入甲醛隐藏氨基避免干扰羧基和碱的反应;
(4)①加入足量稀硝酸酸化的硝酸银溶液,沉淀溶液中氯离子,过滤得到沉淀洗涤干燥称量沉淀质量;
③硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,滴入反应终点的指示剂可以选择铁盐溶液,滴入最后一滴溶液呈血红色证明反应终点;依据反应过程试剂用量计算得到.
(2)①淀粉发生水解生成葡萄糖,据此写化学方程式;
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,再通过检验葡萄糖中的醛基证明产物,据此答题;
(3)加入甲醛隐藏氨基避免干扰羧基和碱的反应;
(4)①加入足量稀硝酸酸化的硝酸银溶液,沉淀溶液中氯离子,过滤得到沉淀洗涤干燥称量沉淀质量;
③硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,滴入反应终点的指示剂可以选择铁盐溶液,滴入最后一滴溶液呈血红色证明反应终点;依据反应过程试剂用量计算得到.
解答:
解:(1)羧基能与氢氧根反应生成羧酸根,根据 可知,离子(1)的结构简式是
可知,离子(1)的结构简式是 ,故答案为:
,故答案为: ;
;
(2)①淀粉发生水解生成葡萄糖,化学方程式为:(C6H10O5)3+nH2O
nC6H12O(葡萄糖),故答案为:(C6H10O5)3+nH2O
nC6H12O(葡萄糖);
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,需要加氢氧化钠溶液,再通过检验葡萄糖中的醛基证明产物,需要加银氨溶液或新制氢氧化铜悬浊液,故答案为:a、c;
(3)依据反应R-NH2+HCHO→R-N=CH2+H2O,加入甲醛和氨基结合保护,避免影响氢氧化钠中和羧基的反应,故答案为:掩蔽氨基,避免氨基影响羧基和NaOH的中和反应;
(4)①加入足量稀硝酸酸化的硝酸银溶液,沉淀溶液中氯离子,过滤得到沉淀洗涤干燥称量沉淀质量,故答案为:洗涤、干燥所得沉淀;
②硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,滴入反应终点的指示剂可以选择铁盐溶液,滴入最后一滴溶液呈血红色证明反应终点;
取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,用浓度为c2mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点,说明加入的指示剂是硝酸铁,已知:AgSCN是难溶于水的沉淀.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,依据氯元素守恒得到氯化钠质量分数=
×100%=
%,
故答案为:Fe(NO3)3;
%.
 可知,离子(1)的结构简式是
可知,离子(1)的结构简式是 ,故答案为:
,故答案为: ;
;(2)①淀粉发生水解生成葡萄糖,化学方程式为:(C6H10O5)3+nH2O
| 催化剂 |
| △ |
| 催化剂 |
| △ |
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,需要加氢氧化钠溶液,再通过检验葡萄糖中的醛基证明产物,需要加银氨溶液或新制氢氧化铜悬浊液,故答案为:a、c;
(3)依据反应R-NH2+HCHO→R-N=CH2+H2O,加入甲醛和氨基结合保护,避免影响氢氧化钠中和羧基的反应,故答案为:掩蔽氨基,避免氨基影响羧基和NaOH的中和反应;
(4)①加入足量稀硝酸酸化的硝酸银溶液,沉淀溶液中氯离子,过滤得到沉淀洗涤干燥称量沉淀质量,故答案为:洗涤、干燥所得沉淀;
②硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,滴入反应终点的指示剂可以选择铁盐溶液,滴入最后一滴溶液呈血红色证明反应终点;
取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,用浓度为c2mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点,说明加入的指示剂是硝酸铁,已知:AgSCN是难溶于水的沉淀.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,硝酸银沉淀氯离子,过量的硝酸银被NH4SCN溶液沉淀生成AgSCN沉淀,依据氯元素守恒得到氯化钠质量分数=
| (c1V1-C 2V 2)×10 -3mol×58.5g/mol |
| mg |
| 5.85(c 1V 1-c 2V 2) |
| m |
故答案为:Fe(NO3)3;
| 5.85(c 1V 1-c 2V 2) |
| m |
点评:本题考查了物质性质的实验探究,物质组成的分析判断,实验基本操作和实验过程的分析应用时解题关键,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、向足量的NaHS 溶液中通入少量氯气:HS-+Cl2=S↓+H++2Cl- |
| B、碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ |
| C、饱和的Na2CO3溶液中通CO2气体:2Na++CO32-+H2O+CO2=2NaHCO3↓ |
D、把水杨酸(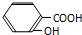 )加到足量的Na2C03溶液中: )加到足量的Na2C03溶液中: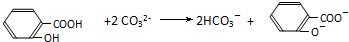 |
下列关于能量变化的说法正确的是( )
| A、相同质量的水和冰相比较,冰的能量高 |
| B、化学反应过程中能量的变化只有吸热和放热两种表现形式 |
| C、化学反应既遵循质量守恒,也遵循能量守恒 |
| D、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
pH相同的NaOH溶液和氨水,分别用蒸馏水稀释原体积的m和n倍,若稀释后两溶液的pH仍然相同,则m和n的关系是( )
| A、m>n | B、m<n |
| C、m=n | D、不能确定 |
下列关于蛋白质的叙述不正确的是( )
| A、蛋白质溶液中加入饱和的硫酸铵溶液,蛋白质析出,如再加水能溶解 |
| B、蛋白质中的蛋白质分子能透过滤纸,但不能透过半透膜 |
| C、重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒 |
| D、浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质与浓硝酸发生了颜色反应 |
既能与NaOH反应,又能与NaHCO3反应的是( )
A、 |
| B、CH3COOH |
| C、CH3CHO |
| D、CH3CH2OH |
pH为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
| A、pH>7 | B、pH<7 |
| C、pH=7 | D、无法确定 |
2009年2月,日本产业技术综合研究所能源技术研究部门能源界面技术研究小组组长周豪慎和日本学术振兴会(JSPS)外籍特别研究员王永刚共同研发出了新构造的大容量锂空气电池.下列说法不正确的是( )


| A、放电时的正极反应为O2+2H2O+4e-═4OH- |
| B、充电时正极附近pH降低 |
| C、若用该电池作电源电解硫酸镁溶液,当电路中有0.02转移时,阴极增重0.24g |
| D、在该电池中,放电反应生成的不是固体的Li2O,而是容易溶解在水性电解液中的LiOH (氢氧化锂).因此,氧化锂在空气电极堆积后,不会导致工作停止 |
 A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如下图所示.(除(2)外,反应均在常温下进行)
A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如下图所示.(除(2)外,反应均在常温下进行)