题目内容
16.下列粒子共存的说法正确或离子方程式表达符合要求的是( )| A. | 加入铝粉有氢气生成的溶液中可能大量存在:Ba2+、AlO2-、Cl- | |
| B. | 在含有NH3•H2O的溶液中可能大量共存的离子:Fe3+、HCO3-、NO3- | |
| C. | 亚硫酸的电离:H2SO3═HSO3-+H+ | |
| D. | 向NaHSO4溶液中加入Ba(OH)2溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
分析 A.加入铝粉有氢气生成的溶液可能呈酸性或碱性;
B.与NH3•H2O反应的离子不能大量共存;
C.亚硫酸为二元弱酸;
D.向NaHSO4溶液中加入Ba(OH)2溶液呈中性,二者按2:1反应.
解答 解:A.加入铝粉有氢气生成的溶液可能呈酸性或碱性,碱性条件下可大量共存,故A正确;
B.与NH3•H2O反的Fe3+、HCO3-不能大量共存,故B错误;
C.亚硫酸为二元弱酸,电离方程式为H2SO3?HSO3-+H+,故C错误;
D.向NaHSO4溶液中加入Ba(OH)2溶液呈中性,二者按2:1反应,应为2H++SO42-+Ba2++OH-═BaSO4↓+2H2O,故D错误.
故选A.
点评 本题考查离子反应,为高频考点,侧重于离子共存以及离子方程式的书写,为高频考点,注意把握离子的性质以及离子方程式的书写方法,难度不大.

练习册系列答案
相关题目
6.CO2是最常见的酸性氧化物之一,实验室用一定浓度的NaOH溶液吸收二氧化碳可以得到相应的盐溶液.某实验兴趣小组对该反应的产物成分进行探究:
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
Ⅱ.有同学认为SO2与CO2相似也可以与NaOH溶液反应.实验发现将过量SO2通入少量一定浓度的NaOH溶液,所得溶液能使pH试纸变红.(不考虑SO2溶解)
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
| 实验步骤 | 预期现象和结论 |
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).
7.有关化学反应速率和限度的说法中,不正确的是( )
| A. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| B. | 工业生产使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 2SO2+O2?2SO3反应中,SO2的转化率不能达到100% | |
| D. | 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快 |
4.下列除杂方法合适并能成功的是( )
| 选项 | 待提纯样品(括号内为杂质) | 除杂方法或实验装置 |
| A | 淀粉胶体(KI溶液) | 过滤 |
| B | 乙酸乙酯(饱和碳酸钠溶液) | 蒸馏,收集77℃下馏分 |
| C | CO2(SO2) | 通过盛有饱和碳酸钠溶液的洗气瓶并干燥 |
| D | 氯气(氯化氢) | 通过盛有饱和食盐水的洗气瓶并干燥 |
| A. | A | B. | B | C. | C | D. | D |
11.水杨酸环已酯具有花香气味,可作为香精配方.其合成路线如下:
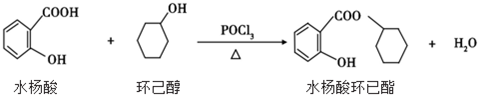
下列说法正确的是( )

下列说法正确的是( )
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
8.下列离子方程式书写正确的是( )
| A. | 制取Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-═CaCO3+SO42- | |
| C. | 泡沫灭火器灭火原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O═CO32-+2C6H5OH |
5.下列物质与其用途相符合的是( )
| A. | Si-光导纤维 | B. | SO3-杀菌消毒 | ||
| C. | SiO2-半导体材料 | D. | Al2O3-耐高温材料 |
6.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| B. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 用石墨电极电解Cu(NO3)2溶液,当转移电子数为0.2NA时,阴极析出6.4g金属 | |
| D. | 常温下含有NA个NO2、N2O4分子的混合气体,温度降至0℃,其体积约为22.4L |