题目内容
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.
(1)Y原子核外共有 种不同运动状态的电子,T原子有 种不同能级的电子.
(2)X、Y、Z的最简单氢化物的稳定性由弱到强的顺序是
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为 .
(4)Z与R能形成化合物甲,1mol甲中含 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为 , .
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为 .
(6)T与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为 .
(7)丁二酮肟常用于检验T2+:在稀氨水中,丁二酮肟与T2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.

(1)Y原子核外共有
(2)X、Y、Z的最简单氢化物的稳定性由弱到强的顺序是
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为
(4)Z与R能形成化合物甲,1mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(7)丁二酮肟常用于检验T2+:在稀氨水中,丁二酮肟与T2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.

考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,且X的一种氢化物为1:2型且所有原子共平面,则X应为C元素,它的1:2型氢化物为乙烯;
Z的L层上有2个未成对电子,即核外电子排布为:1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素、Y为氮元素;
Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比Z大,而Z的电子排布为:1s22s22p4,所以Q的电子排布为:1s22s22p63s2,即Q为Mg元素;
而G为金属元素且原子序数介于氧和镁元素之间,所以G为钠元素;
R单质是制造各种计算机、微电子产品的核心材料,R为Si元素;
T处于周期表的d区,且原子序数是d区中最大的,且核电荷数小于36,根据元素周期表可知,T为Ni元素,
据此以上分析及元素周期律知识解答(1)-(5);
(6)利用均摊法计算晶胞中含有的原子数;
(7)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间.
Z的L层上有2个未成对电子,即核外电子排布为:1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素、Y为氮元素;
Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比Z大,而Z的电子排布为:1s22s22p4,所以Q的电子排布为:1s22s22p63s2,即Q为Mg元素;
而G为金属元素且原子序数介于氧和镁元素之间,所以G为钠元素;
R单质是制造各种计算机、微电子产品的核心材料,R为Si元素;
T处于周期表的d区,且原子序数是d区中最大的,且核电荷数小于36,根据元素周期表可知,T为Ni元素,
据此以上分析及元素周期律知识解答(1)-(5);
(6)利用均摊法计算晶胞中含有的原子数;
(7)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间.
解答:
解:X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为碳元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为氧元素,且Y为氮元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比Z大,而Z的电子排布为1s22s22p4,所以Q的电子排布为1s22s22p63s2,即Q为镁元素,而G为金属元素且原子序数介于氧和镁元素之间,所以G为钠元素;R单质是制造各种计算机、微电子产品的核心材料,R为硅元素;T处于周期表的d区,且原子序数是d区中最大的,且核电荷数小于36,根据元素周期表可知,T为镍元素,
(1)Y为N元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子;
T为Ni元素,它的核外电子排布式为:1s22s22p63s23p63d84s2,所以它有7个能级,
故答案为:7;7;
(2)C、N、O位于元素周期表同一周期,且原子序数依次增大,根据元素周期律可知,它们的最简单氢化物的稳定性由弱到强,则X、Y、Z的最简单氢化物的稳定性由弱到强的顺序为:CH4<NH3<H2O,
故答案为:CH4<NH3<H2O;
(3)OCN-与CO2互为等电子体,所以它们结构相似,在二氧化碳中碳的价层电子对数为:
=2,所以碳的杂化方式为sp杂化,
故答案为:sp杂化;
(4)化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O键,所以1mol二氧化硅中含有4molSi-O键;
SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为:
=4,所以SiF4的空间构型为正四面体,H2O中氧原子的价层电子对数为:
=4,所以H2O的空间构型为V形,
故答案为:4;正四面体形;V形;
(5)在NaF、MgF2、SiF4中NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)在镍与镧形成的晶钵中镧原子分布在立方体的八个顶点上,数目为:8×
=1,镍原子分布在体心和侧面的面心以及上下底面上,数目为1+8×
=5,所以合金的化学式为LaNi5,故答案为:LaNi5;
(7)中心原子提供空轨道配体提供孤电子对形成配位键,氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间,在图中用箭头和“…”表示出配位键和氢键为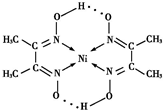 ,故答案为:
,故答案为: .
.
(1)Y为N元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子;
T为Ni元素,它的核外电子排布式为:1s22s22p63s23p63d84s2,所以它有7个能级,
故答案为:7;7;
(2)C、N、O位于元素周期表同一周期,且原子序数依次增大,根据元素周期律可知,它们的最简单氢化物的稳定性由弱到强,则X、Y、Z的最简单氢化物的稳定性由弱到强的顺序为:CH4<NH3<H2O,
故答案为:CH4<NH3<H2O;
(3)OCN-与CO2互为等电子体,所以它们结构相似,在二氧化碳中碳的价层电子对数为:
| 4 |
| 2 |
故答案为:sp杂化;
(4)化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O键,所以1mol二氧化硅中含有4molSi-O键;
SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为:
| 4+4 |
| 2 |
| 6+2 |
| 2 |
故答案为:4;正四面体形;V形;
(5)在NaF、MgF2、SiF4中NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)在镍与镧形成的晶钵中镧原子分布在立方体的八个顶点上,数目为:8×
| 1 |
| 8 |
| 1 |
| 2 |
(7)中心原子提供空轨道配体提供孤电子对形成配位键,氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间,在图中用箭头和“…”表示出配位键和氢键为
 ,故答案为:
,故答案为: .
.
点评:本题考查了位置结构与性质的关系,题目难度中等,试题涉及等电子体、原子核外电子排布、元素周期律、晶体的性质、晶胞的计算等知识点,综合性较强、知识点较多,正确推断各元素为解答关键.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
关于HCl、H2SO4、HNO3三大强酸的说法正确的是( )
| A、都是含氧酸 |
| B、都属于强电解质 |
| C、都容易挥发 |
| D、都能与金属Mg发生置换反应 |
已知Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2 CO3)=8.1×10-12,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-15,在下述各银盐饱和溶液中,c(Ag+)由大到小的顺序为( )
| A、Ag2SO4>AgCl>Ag2CO3>AgI |
| B、Ag2SO4>Ag2CO3>AgCl>AgI |
| C、Ag2SO4 >AgCl>AgI>Ag2CO3 |
| D、Ag2SO4>Ag2CO3>AgI>AgCl |