题目内容
5.在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态的现象是( )| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.
解答 解:A.该反应是一个反应前后气体体积不变的化学反应,无论反应是否达到平衡状态,容器中气体的压强始终不变,所以不能证明达到了平衡状态,故A错误;
B. 由于A是固体,反应两边气体的质量不相等,容器的体积不变,混合气体密度不变,说明各组分的浓度不变,达到了平衡状态,故B正确;
C.由于反应两边气体的化学计量数相等,物质的量始终不变,所以物质的量不变不能判断是否达到了平衡状态,故C错误;
D.单位时间内生成n mol C的同时消耗2n molB,表示的都是正逆反应速率,不能判断正逆反应速率是否相等,故D错误;
故选B.
点评 本题考查化学平衡状态判断,为高频考点,注意:只有反应前后改变的物理量才能作为判断化学平衡的依据,反应前后不改变的物理量不能作为化学平衡的判断依据,本题难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)?2SO3(g);△H1=-197kJ/mol K1=a
(2)2NO(g)+O2(g)?2NO2(g);△H2=-144kJ/mol K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g);△H3=m kJ/mol K3=c
下列说法正确的是( )
(1)2SO2(g)+O2(g)?2SO3(g);△H1=-197kJ/mol K1=a
(2)2NO(g)+O2(g)?2NO2(g);△H2=-144kJ/mol K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g);△H3=m kJ/mol K3=c
下列说法正确的是( )
| A. | m=-26.5 2c=a-b | B. | m=-53 c2=$\frac{a}{b}$ | C. | m=-26.5 c2=$\frac{a}{b}$ | D. | m=-53 2c=a-b |
16.下列有关实验及其分析叙述正确的是( )
| A. | 向2.0mL浓度均为0.lmol•L-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比Agl的Ksp大 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解 | |
| C. | 向AIC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失 | |
| D. | 将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生 |
13.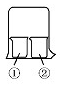 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) | ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | 淀粉KI溶液浓硝酸无明显变化 | B. | 酚酞溶液浓盐酸无明显变化 | ||
| C. | AlCl3溶液浓氨水有白色沉淀 | D. | 湿润红纸条饱和氯水红纸条褪色 |
10.下列物质中,不能用酸性KMnO4溶液鉴别,但可用溴水鉴别的是( )
| A. | 己烷 苯 | B. | 己烯 苯 | C. | 己烯 甲苯 | D. | 己烷 己烯 |
15.光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图:

回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
图中“操作X”的名称为精馏(或蒸馏);PCl3的电子式为 .
.
(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.

回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.

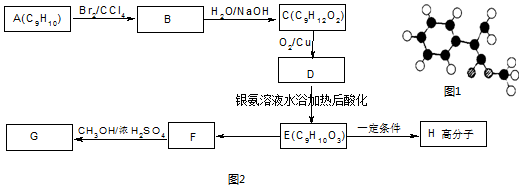
 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为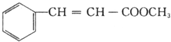 .
.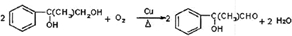
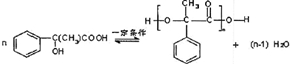 .
.