题目内容
13.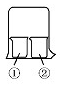 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) | ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | 淀粉KI溶液浓硝酸无明显变化 | B. | 酚酞溶液浓盐酸无明显变化 | ||
| C. | AlCl3溶液浓氨水有白色沉淀 | D. | 湿润红纸条饱和氯水红纸条褪色 |
分析 A.硝酸具有挥发性、强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色;
B.浓盐酸具有挥发性,酚酞溶液在酸性条件下为无色;
C.浓氨水具有挥发性,氨水与氯化铝反应生成氢氧化铝;
D.饱和氯水挥发出氯气,氯气与水反应生成HClO,HClO具有漂白性.
解答 解:A.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故A错误;
B.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故B正确;
C.浓氨水具有挥发性,挥发出的氨气,溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;
D.饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO,HClO具有漂白性,使湿润红纸条褪色,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力的考查,涉及化学实验、元素化合物性质等,难度不大,明确元素化合物的性质即可分析解答本题,注意“烟”和“雾”的区别.

练习册系列答案
相关题目
4.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
1.下列实验操作中,能够用于分离固体与液体混合物的是( )
| A. | 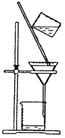 | B. | 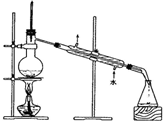 | ||
| C. |  | D. |  |
8.常温下,下列溶液中一定能大量共存的离子组是( )
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
18.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 7.80 g Na2O2与5.85 g NaCl所含阴离子数相等 | |
| D. | 常温常压下,18g H2O含有的氢原子数为3NA |
5.在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态的现象是( )
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
2.某元素R最高价氧化物的水化物分子式是H2RO4,则在气态氢化物中R元素的化合价是( )
| A. | -2 | B. | -3 | C. | +6 | D. | -6 |
3.(1)钠镁铝三种元素中第一电离能最大的是镁.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)微粒间存在非极性键、配位键、氢键及范德华力的是E.
A.NH4Cl晶体 B.Na3AlF6晶体 C.Na2CO3•10H2O晶体
D.CuSO4溶液 E.CH3COOH溶液
(4)部分共价键键能数据如下表:
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-93kJ•mol-1.
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能.
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式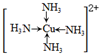 .
.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)微粒间存在非极性键、配位键、氢键及范德华力的是E.
A.NH4Cl晶体 B.Na3AlF6晶体 C.Na2CO3•10H2O晶体
D.CuSO4溶液 E.CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式
 .
.