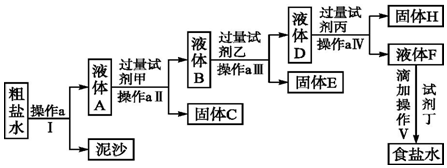
题目内容
17.有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管(1)现要配制500mL、1mol•L-1的硫酸溶液,需用质量分数为98%、密度为1.84g•cm-3的浓硫酸27.2mL.
(2)本实验用到的基本实验仪器除玻璃棒、烧杯、量筒外还有胶头滴管;250mL容量瓶.
(3)容量瓶在使用前需要检验漏水.
(4)浓硫酸稀释时注意的事项将浓硫酸沿着烧怀壁慢慢的注入水里,并不断搅拌
(5)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”).
量取浓硫酸时俯视液面偏低;摇匀后发现液面低于刻度线再加水:偏低;容量瓶中原有少量蒸馏水不变;定容时俯视观察液面:偏高.
分析 (1)可设出溶液的体积,利用m=ρV求出质量,根据溶液稀释前后溶质质量不变来列式解答;
(2)据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)带瓶塞或活塞的仪器使用前都需要检查是否漏水;
(4)浓硫酸稀释操作:把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,不断用玻璃棒搅拌使其散热;
(5)分析操作对溶质的物质的量、溶液体积的影响,根据c=$\frac{n}{V}$分析操作对所配溶液浓度的影响;
解答 解:(1)设需质量分数为98%、密度为1.84 g•cm-3的浓硫酸的体积为V,V×1.84 g•cm-3×98%=0.5 L×1 mol•L-1×98 g•mol-1,V≈27.2 mL;
故答案为:27.2;
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用50mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以需要的仪器除玻璃棒、烧杯、量筒外还有胶头滴管、250mL容量瓶,
故答案为:胶头滴管;250mL容量瓶;
(3)容量瓶带有瓶塞,使用前应检查是否漏水;
故答案为:漏水;
(4)稀释浓硫酸时,要将浓硫酸沿着烧杯壁慢慢的注入水里,并不断搅拌,防止局部温度过高而溅出液体,
故答案为:将浓硫酸沿着烧怀壁慢慢的注入水里,并不断搅拌;
(5)量取浓硫酸时俯视液面,浓硫酸的体积偏小,导致所配溶液溶质的物质的量偏小,所配溶液的浓度偏低;
摇匀后发现液面低于刻度线再加水,导致所配溶液的体积偏大,所配溶液的浓度偏低;
容量瓶中原有少量蒸馏水,对溶液的体积和溶质的物质的量无影响,所配溶液的浓度不变;
定容时俯视观察液面,导致所配溶液的体积偏小,所配溶液的浓度偏高;
故答案为:偏低;偏低;不变;偏高;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,题目难度不大.

 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(2)已知A元素原子的M层上的电子数是K层电子数的3倍,则A在周期表中位置为第3周期ⅥA族;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,则B原子的结构示意图为
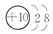 .
.(3)三氧化铀是一种两性氧化物,它在溶液中可以以UO22+和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:
①UO3与强碱反应2UO3+2OH-=U2O72-+H2O;
②UO3与强酸反应UO3+2H+=UO22++H2O.
| A. | pH试纸使用之前需用蒸馏水润湿 | |
| B. | 用广泛pH试纸测定某溶液的pH为3.5 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 中性溶液的c(H+)=$\sqrt{K_W}$mol•L-1 |