题目内容
15.在一定温度下,体积不变的密闭容器中,发生可逆反应N2(g)+3H2(g)?2NH3(g),下列说法中正确的是( )| A. | 若向密闭容器中再充入N2,则反应速率减慢 | |
| B. | 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol•L-1•s-1 | |
| C. | 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态 | |
| D. | 若某时刻消耗了1molN2同时生成了2molNH3,则表明该反应达到了平衡状态 |
分析 A.反应物浓度增大,反应速率加快;
B.结合v=$\frac{△c}{△t}$计算;
C.浓度不变时为化学平衡状态;
D.消耗了1molN2同时生成了2molNH3,只体现正反应速率的关系.
解答 解:A.若向密闭容器中再充入N2,则反应物浓度增大,可知反应速率加快,故A错误;
B.由v=$\frac{△c}{△t}$可知,体积未知,不能计算0~10s的平均速率,故B错误;
C.若某时刻N2、H2、NH3的浓度不再发生变化,反应达到化学平衡状态,符合特征“定”,故C正确;
D.消耗了1molN2同时生成了2molNH3,只体现正反应速率的关系,则不能判定是否为平衡状态,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,把握浓度对反应速率的影响及平衡状态的判定为解答的关键,侧重分析与应用能力的考查,注意平衡状态的特征及应用,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
5.水果散发出诱人的香味,你能闻到香味的原因是( )
| A. | 分子之间有间隔 | B. | 分子的质量很小 | C. | 分子在不断运动 | D. | 分子的体积很小 |
6.某无色溶液中存在大量的NH4+、H+、SO42-,该溶液中还可能大量存在的离子是( )
| A. | Cu2+ | B. | Al3+ | C. | CH3COO- | D. | HCO3- |
3.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | 纤维素、蛋白质、油脂都是天然有机高分子化合物 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
10.科学网报道:在超音速客机中利用微波光谱学首次发现具有鱼腥味的H2O3,下列物质的摩尔质量H2O3相同的是( )
| A. | H2O2 | B. | CaLiH3 | C. | NaN3 | D. | H2SO4 |
20.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 23gNa变为Na+时失去的电子数为NA | B. | 18g水的电子数为NA | ||
| C. | 8gHe所含的分子数为NA | D. | 16gO2与16gO3所含的原子数均为NA |
13.下列化学用语中,正确的是( )
| A. | 氯化钠的电子式为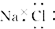 | |
| B. | 镁的原子结构示意图为 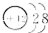 | |
| C. | 氯化氢分子的形成过程可用电子式表示式: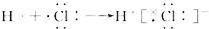 | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
14.下列关于氯气的说法错误的是( )
| A. | 是一种有强烈刺激性气味的气体 | B. | 可用于自来水消毒 | ||
| C. | 与氢氧化钠溶液反应可制成漂白液 | D. | 能使干燥的红色布条褪色 |