题目内容
6.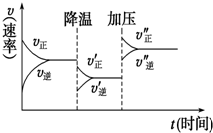 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )| A. | 正反应是放热反应 | B. | D可能是气体 | ||
| C. | 逆反应是放热反应 | D. | A、B、C、D均为气体 |
分析 由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此可解答该题.
解答 解:A.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,故A正确;
B.图示增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,若A、B是气体,D是液体或固体,增大压强平衡向正反应方向移动与图示一致,D为气体不能符合正反应是气体体积减小的反应,则B错误;
C.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,故C错误;
D.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,图示增大压强平衡向正反应方向移动,故D错误;
故选A.
点评 本题考查化学反应速率与化学平衡的图象问题,根据温度、压强对反应速率的影响判断平衡移动的方向是解答该题的关键,注意压强对平衡移动的影响与化学计量数的关系,为易错点,题目难度中等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
8.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 100mL1mol/L的盐酸中含HCl分子数为0.1NA | |
| B. | 7.8gNa2O2和Na2S的混合物中阴离子数目为0.2NA | |
| C. | 标准状况下,2.24L SO3中含有氧原子数目为0.3NA | |
| D. | 2gD216O中含中子、质子、电子数目均为NA |
1.某种直链饱和脂肪酸甘油酯22.25g,皂化时需3.00g NaOH,则与这种脂肪酸中的碳原子数接近的数值是( )
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
18.将质量为24.6g的铝、铜合金加入到1000mL的稀硝酸中,固体完全溶解,收集到的还原产物全是NO,标准状况下的体积为8.96L,向所得溶液中加入物质的量浓度为4mol/L NaOH溶液至沉淀质量最大时所用体积为400mL,则下列有关叙述中不正确的是( )
| A. | 被还原的硝酸的物质的量为0.4mol | |
| B. | 测得生成沉淀的质量比原合金的质量增加20.4g | |
| C. | 原硝酸的浓度为1.6 mol/L | |
| D. | 合金中铝的质量为5.4g |
15.某非金属元素在化学反应中从化合态变为游离态,则该元素( )
| A. | 一定被氧化 | B. | 一定被还原 | ||
| C. | 可能被氧化,也可能被还原 | D. | 化合价升高为O |
16.下列离子方程式正确的是( )
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
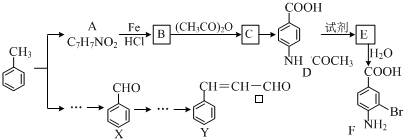
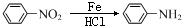
 +(CH3CO)2O→
+(CH3CO)2O→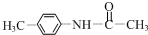 +CH3COOH.
+CH3COOH.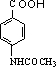 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$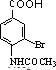 +HBr.
+HBr.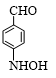 ;
;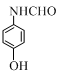 ;
;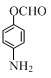 ;
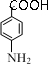
;
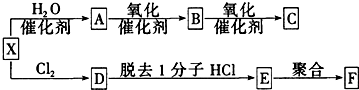
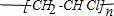 .
. 和b.
和b.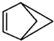 .请回答下列问题:
.请回答下列问题: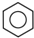 结构在下列哪些方面不同D(填字母代号).
结构在下列哪些方面不同D(填字母代号).