题目内容
15.某非金属元素在化学反应中从化合态变为游离态,则该元素( )| A. | 一定被氧化 | B. | 一定被还原 | ||
| C. | 可能被氧化,也可能被还原 | D. | 化合价升高为O |
分析 某非金属元素在化学反应中从化合态变为游离态,可能失去电子也可能得到电子,以此来解答.
解答 解:某非金属元素在化学反应中从化合态变为游离态,如2H2S+SO2=2H2O+3S↓中S由-2价升高为0,S由+4价降低为0,则S元素失去电子也可能得到电子,既被氧化也被还原,只有C符合,
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素的化合价判断,题目难度不大.

练习册系列答案
相关题目
19.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制 NO2:Cu+4HNO3(浓)═Cu2++2 NO3-+NO2↑+2H2O | |
| C. | 向同浓度的NaOH和Na2CO3,的混合液中加少量稀盐酸:CO32-+2H+═CO2↑+3H2O | |
| D. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
6.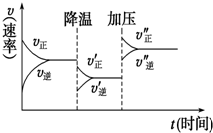 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )| A. | 正反应是放热反应 | B. | D可能是气体 | ||
| C. | 逆反应是放热反应 | D. | A、B、C、D均为气体 |
3. 甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
 甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
10.下列说法正确的是( )
| A. | 组成上一个或若干个CH2原子团,且符合同一通式的有机物互称为同系物 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 苯的邻位二元取代物只有一种说明苯环中不存在单双键交替 | |
| D. | CH3-CH3+Cl2→CH2ClCH2Cl的反应类型为加成反应 |
4.下列化学反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
5.参考表中物质的熔点,回答有关问题.
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的离子半径大小有关,随着该值的增大,熔点依次降低.
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
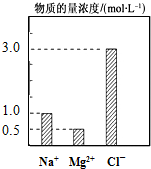 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题: