题目内容
18.将质量为24.6g的铝、铜合金加入到1000mL的稀硝酸中,固体完全溶解,收集到的还原产物全是NO,标准状况下的体积为8.96L,向所得溶液中加入物质的量浓度为4mol/L NaOH溶液至沉淀质量最大时所用体积为400mL,则下列有关叙述中不正确的是( )| A. | 被还原的硝酸的物质的量为0.4mol | |
| B. | 测得生成沉淀的质量比原合金的质量增加20.4g | |
| C. | 原硝酸的浓度为1.6 mol/L | |
| D. | 合金中铝的质量为5.4g |
分析 设Al为xmol,Cu为ymol,则$\left\{\begin{array}{l}{27x+64y=24.6}\\{3x+2y=\frac{8.96}{22.4}×(5-2)}\end{array}\right.$,解得x=0.2,y=0.3,
A.生成NO时对应的硝酸被还原;
B.生成沉淀的质量比原合金的质量增加为n(OH-)×17g/mol;
C.由原子守恒计算硝酸的物质的量,再结合c=$\frac{n}{V}$计算浓度;
D.结合m=nM计算.
解答 解:设Al为xmol,Cu为ymol,则$\left\{\begin{array}{l}{27x+64y=24.6}\\{3x+2y=\frac{8.96}{22.4}×(5-2)}\end{array}\right.$,解得x=0.2,y=0.3,
A.生成NO为$\frac{8.96L}{22,4L/mol}$=0.4mol,被还原的硝酸的物质的量为0.4mol,故A正确;
B.生成沉淀的质量比原合金的质量增加为n(OH-)×17g/mol=(0.2×3+0.3×2)×17g/mol=20.4g,故B正确;
C.由生成沉淀最大可知剩余的硝酸根离子,原硝酸的物质的量=剩余的硝酸根离子+NO的物质的量,可知硝酸的物质的量为4mol/L×0.4L+0.4mol=2mol,原硝酸浓度为$\frac{2mol}{1L}$=2mol/L,故C错误;
D.合金中铝的质量为0.2mol×27g/mol=5.4g,故D正确;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒、质量守恒等为解答的关键,侧重分析与计算能力的考查,注意生成沉淀质量最大时溶质只有NaNO3,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.在1.01×105Pa、120℃的条件下,某有机气体完全燃烧后恢复至原来的温度和压强,前后气体体积不发生变化,则该有机物可能是( )
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
3.下列说法正确的是( )
| A. | 将氯化铝溶液滴入浓氢氧化钠溶液中,立刻产生大量白色沉淀 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | A1Cl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 常温下,Al(OH)3既能与NaOH溶液反应又能与稀硫酸反应 |
6.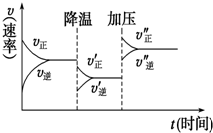 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )| A. | 正反应是放热反应 | B. | D可能是气体 | ||
| C. | 逆反应是放热反应 | D. | A、B、C、D均为气体 |
3. 甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
 甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素.下列各组物质可按下图转化的是( )
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
10.下列说法正确的是( )
| A. | 组成上一个或若干个CH2原子团,且符合同一通式的有机物互称为同系物 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 苯的邻位二元取代物只有一种说明苯环中不存在单双键交替 | |
| D. | CH3-CH3+Cl2→CH2ClCH2Cl的反应类型为加成反应 |
8.下列实验“操作和现象”与“结论”对应关系正确的是( )
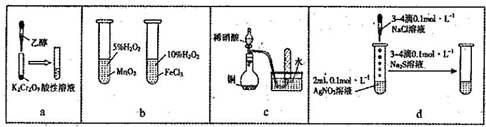

| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,右边试管中产生气泡较为迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图,根据试管中收集到无色气体,不能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
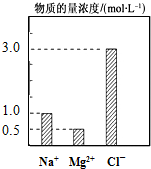 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题: