题目内容
1.已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氢气中1mol H-H键完全断裂时吸收热量436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键断裂时吸收热量为( )| A. | 920kJ | B. | 496kJ | C. | 436kJ | D. | 188kJ |
分析 根据化学反应焓变=旧键断裂吸收的能量-新键生成释放的能量,结合反应方程式进行计算;
解答 解:已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,H2(g)+$\frac{1}{2}$O2(g)=H2O(g),△H=-242KJ/mol,氢气中1mol H-H键完全断裂时吸收热量436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,△H=-242KJ/mol=436kJ/mol+$\frac{1}{2}$×O=O键能-2×463kJ/mol
则氧气中1mol O=O键断裂时吸收热量=496KJ/mol,
故选B.
点评 本题考查反应热的相关计算,题目难度不大,计算的方法是解题的关键,掌握基础是解题关键.

练习册系列答案
相关题目
11.有八种物质:①甲烷、②苯、③聚乙烯、④2-戊烯、⑤2-丁炔、⑥甲苯、⑦苯乙烯,⑧聚氯乙烯.其中既能使酸性高锰酸钾溶液褪色,又能使溴水因化学反应而褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
12.非金属性最强的元素是( )
| A. | C | B. | F | C. | S | D. | Cl |
9.原子序数依次增大的元素b、c、d,它们的最外层电子数分别为6、7、1.b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素的非金属性次序为c>b | |
| B. | c和d形成的化合物存在离子键 | |
| C. | 最高价氧化物对应水化物的酸性:c>b | |
| D. | 离子半径:d+>c- |
16.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲烷分子的比例模型: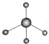 | B. | 甲基的电子式: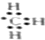 | ||
| C. | 乙烷的分子式:CH3CH3 | D. | 丙烷的结构式:CH3CH2CH3 |
13.某实验小组对H2O2的分解做了如下探究:下表是该实验小组研究影响H2O2分解速率的因素时
记录的一组数据:用10mL H2O2制取150mL(标准状况下)O2所需的时间(s)
(1)①该实验小组在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响.
上述因素对H2O2分解速率的影响分别是:其他条件不变时,浓度越大反应速率越大;其他条件不变时,温度越高反应速率越大;其他条件不变时,催化剂能改变反应速率(或正催化剂能加快反应速率)
②推测t(s)的范围为480s-720s.
(2)下列有关催化剂的说法中正确的是BDF(填序号)
A.催化剂不参与反应,反应前后催化剂的性质和质量都不变
B.催化剂在化学反应前后化学性质和质量都不变
C.催化剂能使不起反应的物质发生反应 D.催化剂能改变化学反应速率
E.任何化学反应都需要催化剂 F.催化剂具有高度的选择性(或专一性)
(3)将质量相同但聚集状态不同的MnO2分别加入15mL 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
①写出上述实验中发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②实验结果表明,催化剂的催化效果与催化剂接触面积有关.
记录的一组数据:用10mL H2O2制取150mL(标准状况下)O2所需的时间(s)
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂加热 | 360 | 480 | t | 720 |
| MnO2催化剂加热 | 10 | 25 | 60 | 120 |
上述因素对H2O2分解速率的影响分别是:其他条件不变时,浓度越大反应速率越大;其他条件不变时,温度越高反应速率越大;其他条件不变时,催化剂能改变反应速率(或正催化剂能加快反应速率)
②推测t(s)的范围为480s-720s.
(2)下列有关催化剂的说法中正确的是BDF(填序号)
A.催化剂不参与反应,反应前后催化剂的性质和质量都不变
B.催化剂在化学反应前后化学性质和质量都不变
C.催化剂能使不起反应的物质发生反应 D.催化剂能改变化学反应速率
E.任何化学反应都需要催化剂 F.催化剂具有高度的选择性(或专一性)
(3)将质量相同但聚集状态不同的MnO2分别加入15mL 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂接触面积有关.
1. X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |