题目内容
下列为一些常见物质的相互转化关系图.已知:A是地壳含量居第四位的金属单质,B为淡黄色粉末,C在常温下为无色液体,J为红褐色固体,L为A的一种复杂氧化物,它是具有磁性的黑色晶体.
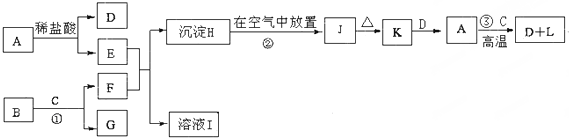
请写出:(1)G和沉淀H的化学式:G ,H ;
(2)H→J过程中的现象: ;
(3)检验溶液I中阳离子的方法是 (填写实验名称即可);
(4)写出下列反应的化学方程式:① ; ② .

请写出:(1)G和沉淀H的化学式:G
(2)H→J过程中的现象:
(3)检验溶液I中阳离子的方法是
(4)写出下列反应的化学方程式:①
考点:无机物的推断
专题:推断题
分析:A是地壳含量居第四位元素,又是金属单质,A为Fe;L为A的一种复杂氧化物,它是具有磁性的黑色晶体,L为Fe3O4;H为A与盐酸反应生成的FeCl2生成的沉淀,H在空气中放置生成红褐色固体J,则H为Fe(OH)2,J为Fe(OH)3,K为Fe2O3;B为淡黄色粉末,C在常温下为无色液体,B和C反应产物能与氯化亚铁反应生成氢氧化亚铁,则B为Na2O2,C为H2O,F为NaOH,G为H2,I为NaCl,以此解答.
解答:
解:A是地壳含量居第四位元素,又是金属单质,A为Fe;L为A的一种复杂氧化物,它是具有磁性的黑色晶体,L为Fe3O4;H为A与盐酸反应生成的FeCl2生成的沉淀,H在空气中放置生成红褐色固体J,则H为Fe(OH)2,J为Fe(OH)3,K为Fe2O3;B为淡黄色粉末,C在常温下为无色液体,B和C反应产物能与氯化亚铁反应生成氢氧化亚铁,则B为Na2O2,C为H2O,F为NaOH,G为H2,I为NaCl,
(1)由上分析知G为H2,H为Fe(OH)2,故答案为:H2;Fe(OH)2;
(2)Fe(OH)2生成Fe(OH)3现象为生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色,故答案为:生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色;
(3)检验NaCl中阳离子的方法是焰色反应,故答案为:焰色反应;
(4)反应①为Na与水的反应,反应方程式为2Na+2H2O=2NaOH+H2↑,反应②为氢氧化亚铁氧化成氢氧化铁的反应,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:2Na+2H2O=2NaOH+H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)由上分析知G为H2,H为Fe(OH)2,故答案为:H2;Fe(OH)2;
(2)Fe(OH)2生成Fe(OH)3现象为生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色,故答案为:生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色;
(3)检验NaCl中阳离子的方法是焰色反应,故答案为:焰色反应;
(4)反应①为Na与水的反应,反应方程式为2Na+2H2O=2NaOH+H2↑,反应②为氢氧化亚铁氧化成氢氧化铁的反应,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:2Na+2H2O=2NaOH+H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查无机物的推断,需要学生熟练掌握元素化合物知识,侧重于学生的分析能力和元素化合物知识的综合运用,注意根据物质的颜色、状态及特殊的转化关系为突破口进行推断,难度较大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、某无色溶液中加入稀盐酸,无明显变化,再加入Ba(NO3)2溶液后,产生白色沉淀,说明原来溶液中含有SO42- |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D、过量的锌与浓硫酸反应产生的气体是SO2 |
有关化工生产原理说法正确的是( )
A、工业上制粗硅:SiO2+C
| ||||
B、海水提镁的主要步骤为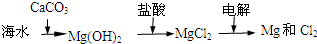 | ||||
C、海水提溴原理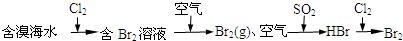 | ||||
| D、硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器 |
室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-) 分别为x mol?L-1和 y mol?L-1,两者的关系正确的是( )
| A、x=10?2y |
| B、x=102y |
| C、x=y |
| D、x>y |
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)