题目内容
草酸亚铁晶体(FeC2O4?2H2O)常用作分析试剂及显影剂等.如图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数).请回答下列问题:
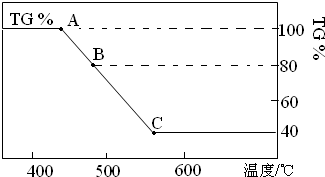
(1)B处残留物的化学式为 .C处残留物的化学式为 .
(2)A→C整个反应过程中总反应的化学方程式为 .
(3)上述FeC2O4?2H2O在氩气气氛中进行热重分析的原因是 .若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为 .
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=
,则反应达平衡时FeO的转化率为 .

(1)B处残留物的化学式为
(2)A→C整个反应过程中总反应的化学方程式为
(3)上述FeC2O4?2H2O在氩气气氛中进行热重分析的原因是
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=
| 1 |
| 3 |
考点:化学方程式的有关计算
专题:计算题
分析:(1)B点残留固体质量占原样品总质量的百分数位80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4?2H2O加热失去结晶水;
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO,B点到C点是FeC2O4分解的反应;
(2)过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水;过程B→C发生的反应是:FeC2O4分解的反应;
(3)FeC2O4?2H2O中铁元素为+2价的铁,易被氧气氧化;分解得到的600℃时的固体为FeO,与浓硫酸反应生成硫酸铁晶体和二氧化硫,将溶液浓缩、冷却,析出Fe2(SO4)3?9H2O;
(4)由(2)分析可知,加热发生反应FeC2O4(s)
FeO+CO(g)+CO2,计算FeC2O4分解生成FeO、CO、二氧化碳的物质的量,令参加反应的CO的物质的量为xmol,利用三段式计算平衡时各组分的物质的量,利用物质的量代替浓度代入平衡常数表达式列方程计算x的值,进而计算FeO转化率.
| 36 |
| 180 |
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO,B点到C点是FeC2O4分解的反应;
(2)过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水;过程B→C发生的反应是:FeC2O4分解的反应;
(3)FeC2O4?2H2O中铁元素为+2价的铁,易被氧气氧化;分解得到的600℃时的固体为FeO,与浓硫酸反应生成硫酸铁晶体和二氧化硫,将溶液浓缩、冷却,析出Fe2(SO4)3?9H2O;
(4)由(2)分析可知,加热发生反应FeC2O4(s)
| ||
解答:
解:(1)由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水,反应方程式为:FeC2O4?2H2O(s)
FeC2O4(s)+2H2O(g),B点对应固体物质的化学式为FeC2O4 ;
由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,化学方程式为FeC2O4
FeO+CO↑+CO2↑;
故答案为:Fe2C2O4;FeO;
(2)过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4?2H2O
FeC2O4+2H2O↑,Fe2C2O4?2H2O
FeO+CO↑+CO2↑+2H2O,过程B→C发生的反应是:FeC2O4分解的反应:FeC2O4
FeO+CO↑+CO2↑,所以A→C整个反应过程中总反应的化学方程式为:Fe2C2O4?2H2O
FeO+CO↑+CO2↑+2H2O,
故答案为:Fe2C2O4?2H2O
FeO+CO↑+CO2↑+2H2O;
(3)FeC2O4?2H2O中铁元素为+2价的铁,易被氧气氧化,为防止FeC2O4在加热过程中被空气中的氧气氧化,所以在氩气气氛中进行热重分析,分解得到的600℃时的固体为FeO,与浓硫酸反应2FeO+4H2SO4(浓)=Fe2(SO4)3?9H2O+SO2↑+4H2O,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为:Fe2(SO4)3?9H2O,
故答案为:防止FeC2O4在加热过程中被空气中的氧气氧化;Fe2(SO4)3?9H2O;
(4)FeC2O4(s)
FeO+CO(g)+CO2(g)
144g 1mol 1mol 1mol
1.44g 0.01mol 0.01mol 0.01mol
CO总物质的量为0.01mol+0.04mol,
令参加反应的CO的物质的量为xmol,则:
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始(mol):0.01 0.05 0.01
变化(mol):x x x
平衡(mol):0.01-x 0.05-x 0.01+x
则
=
,解得x=0.005,
故FeO的转化率=
×100%=50%,
故答案为:50%;
| 36 |
| 180 |
| ||
由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,化学方程式为FeC2O4
| ||
故答案为:Fe2C2O4;FeO;
(2)过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4?2H2O
| ||
| ||
| ||
| ||
故答案为:Fe2C2O4?2H2O
| ||
(3)FeC2O4?2H2O中铁元素为+2价的铁,易被氧气氧化,为防止FeC2O4在加热过程中被空气中的氧气氧化,所以在氩气气氛中进行热重分析,分解得到的600℃时的固体为FeO,与浓硫酸反应2FeO+4H2SO4(浓)=Fe2(SO4)3?9H2O+SO2↑+4H2O,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为:Fe2(SO4)3?9H2O,
故答案为:防止FeC2O4在加热过程中被空气中的氧气氧化;Fe2(SO4)3?9H2O;
(4)FeC2O4(s)
| ||
144g 1mol 1mol 1mol
1.44g 0.01mol 0.01mol 0.01mol
CO总物质的量为0.01mol+0.04mol,
令参加反应的CO的物质的量为xmol,则:
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始(mol):0.01 0.05 0.01
变化(mol):x x x
平衡(mol):0.01-x 0.05-x 0.01+x
则
| 0.01+x |
| 0.05-x |
| 1 |
| 3 |
故FeO的转化率=
| 0.005mol |
| 0.01mol |
故答案为:50%;
点评:本题以草酸亚铁制备为载体,考查化学计算推断物质、化学平衡的计算,根据计算判断各阶段发生的反应是解题的关键,容易忽略草酸亚铁分解生成的一氧化碳、二氧化碳,题目难度较大.

练习册系列答案
相关题目
我国“嫦娥一号”顺利进入绕月轨道,实现绕月探测.据科学家预测月球的土壤中吸附着数百万吨的
He,而在地球上氦元素主要以
He的形式存在.关于
He和
He的叙述中正确的是( )
| ||
| 2 |
| ||
| 2 |
| ||
| 2 |
| ||
| 2 |
A、
| ||||||||
B、
| ||||||||
C、
| ||||||||
D、
|