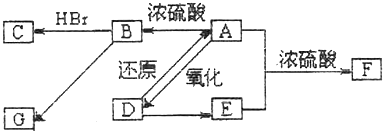
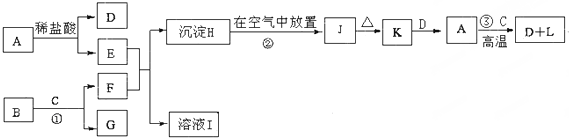
题目内容
甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种.将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体.
回答下面问题:
(1)写出丁与乙反应的离子方程式 .
(2)这四种溶液分别是:甲 ,乙 ,丙 ,丁 .
回答下面问题:
(1)写出丁与乙反应的离子方程式
(2)这四种溶液分别是:甲
考点:无机物的推断
专题:
分析:甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种.将它们两两混合后,由复分解反应可知,只有硝酸银与其它三种物质混合均生成白色沉淀,而只有碳酸钠与盐酸反应生成气体,以此来解答.
解答:
解:甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种.将它们两两混合后,由复分解反应可知,只有硝酸银与其它三种物质混合均生成白色沉淀,而只有碳酸钠与盐酸反应生成气体,结合③丁与乙混合产生无色气体,则丁、乙一定为盐酸、碳酸钠中的一种,②丙与乙或丁混合也产生沉淀,则丙为AgNO3;
①甲与乙或丙混合都产生沉淀,则甲为CaCl2,乙为Na2CO3,丁为HCl,
(1)丁与乙反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(2)由上述分析可知,甲为CaCl2,乙为Na2CO3,丙为AgNO3,丁为HCl,故答案为:CaCl2;Na2CO3;AgNO3;HCl.
①甲与乙或丙混合都产生沉淀,则甲为CaCl2,乙为Na2CO3,丁为HCl,
(1)丁与乙反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(2)由上述分析可知,甲为CaCl2,乙为Na2CO3,丙为AgNO3,丁为HCl,故答案为:CaCl2;Na2CO3;AgNO3;HCl.
点评:本题考查无机物的推断,为高频考点,把握丙为硝酸银及复分解反应的现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
25℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)═Mg2+(q)+2OH-(aq),已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.下列说法错误的是( )
| A、若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大 |
| B、若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色 |
| C、若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动 |
| D、若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大 |
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.1000mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaHCO3 |
| B、Na2CO3 |
| C、Ca(OH)2 |
| D、NaCl |
常温下肯定是酸性溶液的是( )
| A、二氧化硫的水溶液 |
| B、氯化铵的水溶液 |
| C、pH=9的溶液 |
| D、C(H+)<C(OH-)的溶液 |
某学生用氯气杀菌漂白的自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A、石蕊 |
| B、AlCl3 |
| C、NaOH |
| D、AgNO3 |
下列离子方程式正确的是( )
| A、氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-=BaSO4↓ |
| B、向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+H2O+CO2=HClO+CO32- |
| C、向氯化铝溶液中通入过量氨气:Al3++4OH-=AlO2-+2H2O |
| D、过氧化钠与冷水反应:2Na2O2+2H2O=4Na++4OH-+O2↑ |