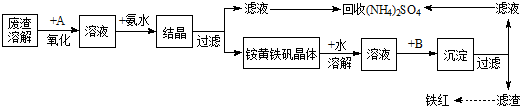
题目内容
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
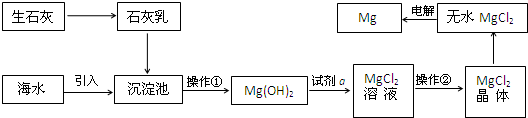
提示:①MgCl2晶体的化学式为MgCl2?6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是 ,操作②的名称是 、 、过滤.
(2)试剂a的名称是 .
(3)用氯化镁电解生产金属镁的化学方程式为: .
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 .

提示:①MgCl2晶体的化学式为MgCl2?6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是
(2)试剂a的名称是
(3)用氯化镁电解生产金属镁的化学方程式为:
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:生石灰溶于水得到氢氧化钙溶液加入沉淀池,沉淀镁离子过滤,得到氢氧化镁固体,加入稀盐酸后溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶,过滤洗涤得到氯化镁晶体,熔融电解得到金属镁;
(1)分析流程操作①为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸;
(3)电解熔融氯化镁得到金属镁和氯气;
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
(1)分析流程操作①为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸;
(3)电解熔融氯化镁得到金属镁和氯气;
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
解答:
解:生石灰溶于水得到氢氧化钙溶液加入沉淀池,沉淀镁离子过滤,得到氢氧化镁固体,加入稀盐酸后溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶,过滤洗涤得到氯化镁晶体,熔融电解得到金属镁;
(1)分析流程操作①是溶液中分离出固体的方法,操作为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
故答案为:过滤;蒸发浓缩;冷却结晶;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸,故答案为:盐酸;
(3)电解熔融氯化镁得到金属镁和氯气,MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑;
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本,
故答案为:MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
(1)分析流程操作①是溶液中分离出固体的方法,操作为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
故答案为:过滤;蒸发浓缩;冷却结晶;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸,故答案为:盐酸;
(3)电解熔融氯化镁得到金属镁和氯气,MgCl2(熔融)
| ||
| ||
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本,
故答案为:MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
点评:本题考查了物质分离的方法和流程判断,物质性质和实验基本操作是解题关键,题目较简单.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
物质分类的依据通常有组成和性质.下列物质分类中,只考虑组成的是( )
| A、Na2SO4是钠盐、硫酸盐、正盐 |
| B、HNO3是一元酸、强酸、挥发性酸 |
| C、NaOH是一元碱、可溶性碱、强碱 |
| D、CO2是酸性氧化物、非金属氧化物、最高价氧化物 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W最外层有5个电子,则下列说法正确的是( )
| W | X | |
| Y | Z |
| A、Z元素氧化物对应水化物的酸性一定强于Y |
| B、X、Y、Z中最简单氢化物稳定性最弱的是Y |
| C、X元素形成的单核阴离子还原性强于Y |
| D、Z元素单质在化学反应中只表现氧化性 |