题目内容
将6.4g Cu放入50mL、18.4mol/L的浓硫酸中,加热,完全反应后,将冷却所得溶液加水稀释至500ml,已知:Cu+H2SO4(浓)
CuSO4+SO2+2H2O,求:余酸稀释后的浓度;生成SO2气体的体积(标况).
| ||
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算Cu的物质的量,根据方程式计算消耗硫酸物质的量、生成二氧化硫的物质的量,进而计算剩余硫酸物质的量,根据c=
计算稀释后硫酸浓度,根据V=nVm计算二氧化硫的体积.
| m |
| M |
| n |
| V |
解答:
解:n(Cu)=
=0.1mol,
Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O
1 2 1
0.1mol n(H2SO4) n(SO2)
n(H2SO4)=
=0.2mol,故剩余硫酸为0.05mol×18.4mol/L-0.2mol=0.72mol,则稀释后c(H2SO4)=
=1.44mol/L;
n(SO2)=
=0.1mol,则 V(SO2)=0.1mol×22.4L/mol=2.24L,
答:余酸稀释后的浓度为1.44mol/L;标况下生成二氧化硫的体积为2.24L.
| 6.4g |
| 64g/mol |
Cu+2 H2SO4(浓)
| ||
1 2 1
0.1mol n(H2SO4) n(SO2)
n(H2SO4)=
| 0.1mol×2 |
| 1 |
| 0.72mol |
| 0.5L |
n(SO2)=
| 0.1mol×1 |
| 1 |
答:余酸稀释后的浓度为1.44mol/L;标况下生成二氧化硫的体积为2.24L.
点评:本题考查化学方程式的计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
100mL 1mol?L-1的AlCl3溶液中,逐渐滴入2mol?L-1 NaOH溶液,得到3.12g沉淀,则加入的NaOH溶液的体积是( )
①180mL ②200mL ③60mL ④120mL.
①180mL ②200mL ③60mL ④120mL.
| A、①② | B、②③ | C、①③ | D、③④ |
已知一定条件下,N2(g)和H2(g)反应生成2mol NH3(g)放出92.4kJ热量.在此条件下,向甲、乙两个容器中分别通入1mol N2和4mol H2,开始时甲、乙两容器的体积相同,若甲容器保持体积不变,乙容器保持压强不变,达到平衡后分别放出热量Q1kJ和Q2kJ,则下列关系正确的是( )
| A、Q1=Q2=92.4 |
| B、Q1=Q2<92.4 |
| C、Q1<Q2<92.4 |
| D、Q2<Q1<92.4 |
用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考如图,从表中选出正确序号 ( )
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| A、A | B、B | C、C | D、D |
下列物质的分离或鉴别正确的是( )
| A、除去混在氯化钠固体中的氯化铵或单质碘,均可用升华的方法 |
| B、若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C、CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| D、鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |
下列做法合理的是( )
| A、为了使食品较长时间保持色香味和口感,可加放适量的苯甲酸钠 |
| B、为了增加婴幼儿奶粉中的含氮量,可在奶粉中适当添加尿素或三聚氰胺 |
| C、在肉制品加工中加大量的亚硝酸钠以保持肉类新鲜 |
| D、在缺碘地区,人们需要用添加碘单质的食盐来补充碘元素 |
下列实验现象描述正确的是( )
| A、氯化氢与氨气相遇,有大量的白雾生成 |
| B、SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色 |
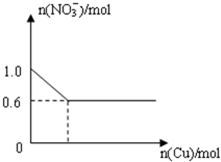 将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如图所示,请回答下列问题: