题目内容
2.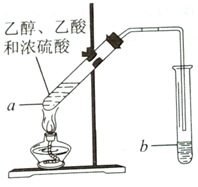 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.(1)乙醇可以催化氧化成乙醛,请写出乙醛分子的结构简式是CH3CHO.
(2)试管a中发生反应的化学方程式为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,该反应类型是取代反应.
(3)试管a中浓硫酸的作用是催化剂、吸水剂.
(4)反应开始前,试管b中应盛放的溶液是饱和碳酸钠溶液.
(5)可用分液的方法把制得的乙酸乙酯分离出来.
分析 (1)乙醛分子中含有醛基;
(2)乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水;
(3)浓硫酸起到了催化作用和吸水作用;
(4)试管b中加碳酸钠溶液,吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分层;
(5)乙酸乙酯难溶于饱和Na2CO3溶液,而且密度比水小.
解答 解:(1)乙醛分子中含有醛基,其结构简式为CH3CHO;
故答案为:CH3CHO;
(2)a中乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,则反应为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,该反应属于取代反应;
故答案为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;取代反应;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
(4)加碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分层,则反应开始前,试管b中盛放的溶液是饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;
(5)乙酸乙酯难溶于饱和Na2CO3溶液,而且密度比水小,所以乙酸乙酯和碳酸钠溶液在一起会分为上下两层,可以用分液法分离;
故答案为:分液.
点评 本题考查有机物的制备实验,把握有机物的结构与性质、有机反应为解答的关键,侧重分析与实验能力的考查,注意混合物分离的应用,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.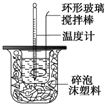
①大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”、“无影响”).
②实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒不能(填“能”、“不能”).
③某同学用0.25mol/L的稀硫酸代替盐酸进行上述实验,实验数据如表
(i)请填写下表中的空白:
(ii)近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8 kJ/mol(保留小数点后一位).
(iii)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.

①大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”、“无影响”).
②实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒不能(填“能”、“不能”).
③某同学用0.25mol/L的稀硫酸代替盐酸进行上述实验,实验数据如表
(i)请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
(iii)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
14.下列说法正确的是( )
| A. | 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 | |
| B. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| C. | 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 | |
| D. | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
11.已知:I2+2S2O${\;}_{3}^{2-}$═S4O${\;}_{6}^{2-}$+2I-
相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入CuO或Cu(OH)2或Cu2(OH)2CO3 ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.