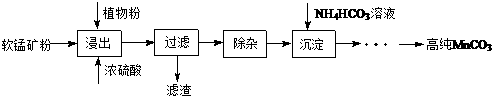
题目内容
16.能充分说明可逆反应N2(g)+O2(g)?2NO(g)已达到平衡状态的是( )| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
分析 可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答 解:A.O2的消耗速率是正方向,NO的消耗速率是逆向,两者的数值之比应为1:2,而不是相等,故A错误;
B.这是可逆反应的特征,而不是平衡状态的标志,故B错误;
C.从反应的开始到平衡的建立总物质的量始终不变,所以不能确定是否达到平衡,故C错误;
D.V正(N2)=V逆(N2),即正逆反应速率相等(同种物质),故D正确;
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列粒子属于等电子体的是( )
| A. | CH4和NH3 | B. | N2和CO | C. | NH2-和H3O+ | D. | HCl和H2O |
4.以下说法正确的是( )
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 水结冰体积膨胀、密度变小,这一事实与水分子间存在氢键有关 | |
| C. | 分子晶体中必含化学键 | |
| D. | 干冰升华破坏了共价键 |
11.下列反应符合如图所示的反应是( )
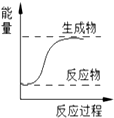

| A. | 金属钠与水的反应 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl (固体)混合 |
1.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.1mol | B. | 0.05mol | C. | 0.15mol | D. | 0.11mol |
8.下列说法正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥⅠA族元素的氢化物中,稳定性最好的沸点也最高 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
5.下列分子中键角最大的是( )
| A. | CH4 | B. | CO2 | C. | H2O | D. | NH3 |
6. 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有三种含氧官能团 | |
| B. | 可发生取代、加成及氧化反应 | |
| C. | 在水溶液中羟基和羧基均能电离出氢离子 | |
| D. | 与足量的钠反应在标况下能产生44.8L气体 |