题目内容
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等.
(1)已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ?mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3,则△H3= kJ?mol-1.
(2)工业上用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键工艺之一,
一种氯化镁晶体脱水的方法是:先将MgCl2?6H2O转化为MgCl2?NH4C1?nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 .
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑.生成2.7gAl时,产生的H2在标准状况下的体积为 L.
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图1为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图.由图可知,下列说法正确的是 (填字母).
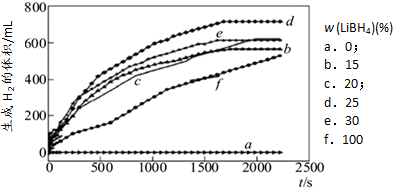
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如2图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).
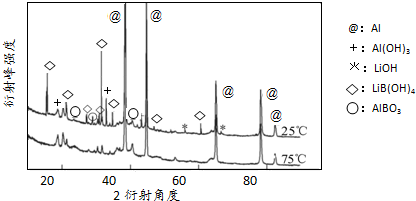
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式).
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g)
 (g)+)+3H2(g)
(g)+)+3H2(g)
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol?L-1,平衡时苯的浓度为b mol?L-1,该反应的平衡常数K= .
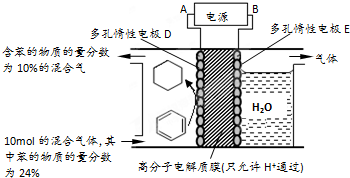
②一定条件下,如图3装置可实现有机物的电化学储氢(忽略其它有机物).生成目标产物的电极反应式为 .
(1)已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ?mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3,则△H3=
(2)工业上用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键工艺之一,
一种氯化镁晶体脱水的方法是:先将MgCl2?6H2O转化为MgCl2?NH4C1?nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑.生成2.7gAl时,产生的H2在标准状况下的体积为
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图1为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图.由图可知,下列说法正确的是

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如2图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g)| FeSO4/Al2O3 |
| 高温 |
 (g)+)+3H2(g)
(g)+)+3H2(g)①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol?L-1,平衡时苯的浓度为b mol?L-1,该反应的平衡常数K=
②一定条件下,如图3装置可实现有机物的电化学储氢(忽略其它有机物).生成目标产物的电极反应式为

考点:用化学平衡常数进行计算,化学方程式的有关计算,用盖斯定律进行有关反应热的计算,电解原理
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)先将MgCl2?6H20转化为MgCl2?NH4Cl?nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁;
(3)根据化学方程式计算;
(4)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
②如图3中无LiBH4,说明与水完全反应;
(5)①化学平衡常数K=
;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
(2)先将MgCl2?6H20转化为MgCl2?NH4Cl?nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁;
(3)根据化学方程式计算;
(4)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
②如图3中无LiBH4,说明与水完全反应;
(5)①化学平衡常数K=
| c(C 6H6).c3(H2) |
| c(C 6H12) |
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
解答:
解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ?mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol-2×(-74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
故答案为:213.4;
(2)MgCl2?NH4Cl?nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2?NH4Cl?nNH3
MgCl2+(n+1)NH3↑+HCl↑;
故答案为:MgCl2?NH4Cl?nNH3
MgCl2+(n+1)NH3↑+HCl↑;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl生成3mol氢气,所以每生成2.7gAl时,生成氢气3.36L;
故答案为:3.36;
(4)①a.25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
b.25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:ab;
②如图2中无LiBH4,说明与水完全反应,故答案为:LiBH4;
(5)①环己烷的起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
mol3?L-3=
=
mol3?L-3,
故答案为:
mol3?L-3;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12.
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol-2×(-74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
故答案为:213.4;
(2)MgCl2?NH4Cl?nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2?NH4Cl?nNH3
| ||
故答案为:MgCl2?NH4Cl?nNH3
| ||
| △ |
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl生成3mol氢气,所以每生成2.7gAl时,生成氢气3.36L;
故答案为:3.36;
(4)①a.25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
b.25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:ab;
②如图2中无LiBH4,说明与水完全反应,故答案为:LiBH4;
(5)①环己烷的起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
| c(C 6H6).c3(H2) |
| c(C 6H12) |
| b×(3b)3 |
| (a-b) |
| 27b4 |
| a-b |
故答案为:
| 27b4 |
| a-b |
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12.
点评:本题考查了化学平衡、电解池原理等知识点,根据化学平衡常数表达式、电解原理等知识点来分析解答,中等难度,答题时注意化学原理的基础知识的灵活运用.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列离子方程式的书写不正确的是( )
| A、Al(OH)3与氨水反应Al(OH)3+NH3?H2O═AlO2-+NH4++2H2O |
| B、铁跟三氯化铁溶液反应 Fe+2Fe3+═3Fe2+ |
| C、铝片浸入硝酸汞溶液 2Al+3Hg2+═2Al3++3Hg |
| D、明矾溶于水 Al3++3H2O═Al(OH)3+3H+ |
已知0.1mol/L的二元酸H2A溶液的pH=4.0则下列说法中正确的是( )
| A、在Na2A、NaHA两溶液中,离子种类不相同 |
| B、相同浓度的Na2A、NaHA两溶液的pH相等 |
| C、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) |
| D、在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
不能够用于鉴别SO2和CO2的试剂是( )
| A、品红溶液 | B、酸性高锰酸钾溶液 |
| C、澄清石灰水 | D、溴水 |
可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变.
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变.
| A、②③④ | B、①②④ |
| C、①③④ | D、③④⑤ |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M.关于该反应的说法中正确的是( )
| A、氧化剂是H3AsO3,SnCl62-是氧化产物 |
| B、还原性:Cl->As |
| C、每生成1 mol As,反应中转移电子的物质的量为6 mol |
| D、M为OH- |
 (1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是