题目内容
可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变.
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变.
| A、②③④ | B、①②④ |
| C、①③④ | D、③④⑤ |
考点:化学平衡状态的判断
专题:
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:①一个N≡N键断裂的同时,有6个N-H键断裂,正逆反应速率相等,达化学平衡状态,故正确;
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1,未体现正与逆的关系,故错误;
③保持其他条件不变时,体系压强不再改变,说明物质的物质的量不变,正逆反应速率相等,达化学平衡状态,故正确;
④NH3、N2、H2的体积分数都不再改变正逆反应速率相等,达化学平衡状态,故正确;
⑤恒温恒容时,混合气体质量一直保持不变,故错误;
故选C.
②v(H2)=0.6mol?L-1?min-1,v(NH3)=0.4mol?L-1?min-1,未体现正与逆的关系,故错误;
③保持其他条件不变时,体系压强不再改变,说明物质的物质的量不变,正逆反应速率相等,达化学平衡状态,故正确;
④NH3、N2、H2的体积分数都不再改变正逆反应速率相等,达化学平衡状态,故正确;
⑤恒温恒容时,混合气体质量一直保持不变,故错误;
故选C.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
常温,某溶液中由水电离产生的c(H+)=10-12,则下列各组离子在该溶液中一定可以大量共存的是( )
| A、K+、Na+、AlO2-、Cl- |
| B、Na+、Cl-、SO42-、HCO3- |
| C、NH4+、Na+、NO3-、SO42- |
| D、Ba2+、Na+、Cl-、NO3- |
长期食用铝含量过高的膨化食品,会干扰人的思维、意识与记忆功能等.下列有关说法中正确的是( )
| A、因铝对人体有害,故不能使用铝锅等炊具 |
| B、一种治疗胃酸过多的药物的主要成分为Al(OH)3,该药应禁止使用 |
| C、膨化食品中的铝元素超标可能是发酵剂明矾造成的 |
| D、用铝箔包装的茶叶不能食用 |
下列化合物不能由单质之间直接化合得到的是( )
| A、SO3 |
| B、Mg3N2 |
| C、SiO2 |
| D、FeCl3 |
科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与溶液中的葡萄糖反应生成纳米金单质颗粒(直径为20~60nm).下列有关说法中错误的是( )
| A、检测时NaAuCl4发生氧化反应 |
| B、葡萄糖的结构简式为CH2OH(CHOH)4CHO |
| C、葡萄糖具有还原性 |
| D、纳米金颗粒分散在水中所得的分散系能产生丁达尔效应 |
下列关于物质的分类正确的是( )
| A、纯碱属于碱 |
| B、钢属于纯净物 |
| C、液氨属于混合物 |
| D、水属于氧化物 |
对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.5mol?L-1,则理论上最多能溶解铜的质量为( )
| A、38.4g | B、57.6g |
| C、64g | D、96g |
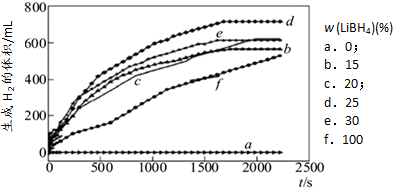
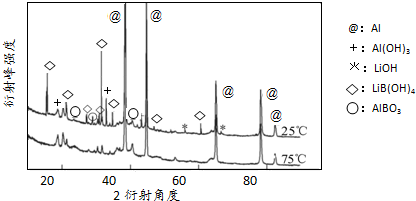
 (g)
(g) (g)+)+3H2(g)
(g)+)+3H2(g)