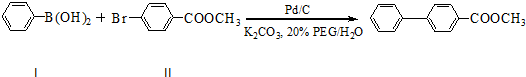题目内容
在一定条件下,下列反应及其化学平衡常数数值如下:以下说法正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×103
2H2(g)+O2(g)?2H2O(g) K2=2×109
2CO2(g)?2CO(g)+O2(g) K3=4×10-9.
2NO(g)?N2(g)+O2(g) K1=1×103
2H2(g)+O2(g)?2H2O(g) K2=2×109
2CO2(g)?2CO(g)+O2(g) K3=4×10-9.
| A、此条件下,可认为NO分解产生O2的反应完全 |
| B、此条件下,2H2O(g)=2H2 (g)+O2(g),此时平衡常数的数值约为5×10-10 |
| C、此条件下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 |
| D、以上说法都不正确 |
考点:化学平衡建立的过程,化学平衡常数的含义
专题:化学平衡专题
分析:A.根据可逆反应的特征来判断;
B.根据方程式的书写反写,平衡常数是原来的倒数;
C.根据化学平衡常数K的数值越大,化学反应进行的程度越大;
D.根据ABC选项的情况回答.
B.根据方程式的书写反写,平衡常数是原来的倒数;
C.根据化学平衡常数K的数值越大,化学反应进行的程度越大;
D.根据ABC选项的情况回答.
解答:
解:A.2NO(g)?N2(g)+O2(g) K1=1×103,该反应为可逆反应,所以不能完全反应到底,故A错误;
B.2H2(g)+O2(g) ?2H2O(g) K2=2×109,所以2H2O(g)
?2H2O(g) K2=2×109,所以2H2O(g) 2H2(g)+O2(g) K3=
2H2(g)+O2(g) K3=
=5×10-10,故B正确;
C.常温下,NO、CO2、H2O三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>CO2>H2O,故C错误;
D.因B正确,故D错误;
故选:B.
B.2H2(g)+O2(g)
 ?2H2O(g) K2=2×109,所以2H2O(g)
?2H2O(g) K2=2×109,所以2H2O(g) 2H2(g)+O2(g) K3=
2H2(g)+O2(g) K3=| 1 |
| 2×109 |
C.常温下,NO、CO2、H2O三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>CO2>H2O,故C错误;
D.因B正确,故D错误;
故选:B.
点评:本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列解释实验事实的方程式不正确的是( )
| A、可用氯气进行自来水的杀菌消毒:Cl2+H2O═HCl+HClO |
| B、将“NO2球”浸泡在热水中,颜色变深:2NO2(g)═N2O4(g)△H<0 |
| C、在刻制印刷电路板时,用FeCl3溶液腐蚀铜箔:2Fe3++3Cu═2Fe+3Cu2+ |
| D、在KNO3和稀硫酸混合液中,铜片溶解:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作指示剂,可导致被测定的盐酸浓度偏高的是( )
| A、未用标准液润洗用蒸馏水洗过的碱式滴定管 |
| B、达到滴定终点,读数时俯视滴定管的刻度 |
| C、滴定过程中振荡锥形瓶有少许盐酸溅出 |
| D、盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液.电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色.对阳极区溶液呈蓝色的正确解释是( )
| A、2 I--2e-=I2 碘遇淀粉变蓝 |
| B、Cu-2e-=Cu2+ Cu2+ 显蓝色 |
| C、2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝 |
| D、4OH--4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝 |
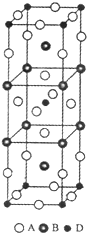 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.