题目内容
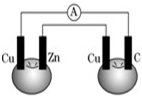 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )| A、锌片是负极 |
| B、两个铜片上都发生氧化反应 |
| C、石墨是阳极 |
| D、两个蕃茄都形成原电池 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:依据图装置分析可知铜和锌电极发生的是原电池反应,锌做负极,铜做正极;右装置是电解池,铜做电解池的阴极,碳做电解池的阳极;
解答:
解:A、装置中依据活泼性差别判断,锌为原电池负极,故A正确;
B、原电池中铜电极上氢离子得电子发生还原反应,右装置是电解池,铜电极为阴极,阴极上阳离子得电子发生还原反应,故B错误;
C、石墨和原电池正极相连做电解池的阳极,故C正确;
D、左装置是原电池,右装置是电解池,故D错误;
故选AC.
B、原电池中铜电极上氢离子得电子发生还原反应,右装置是电解池,铜电极为阴极,阴极上阳离子得电子发生还原反应,故B错误;
C、石墨和原电池正极相连做电解池的阳极,故C正确;
D、左装置是原电池,右装置是电解池,故D错误;
故选AC.
点评:本题考查原电池、电解池原理的分析应用,电极名称、电极判断、电极反应是解题关键,题目较简单.

练习册系列答案
相关题目
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A、分子中三个碳原子可能处于同一直线上 |
B、全氟丙烷的电子式为: |
| C、相同压强下,沸点:C3F8<C3H8 |
| D、全氟丙烷仅有一种结构 |
下列有关物质归类一定正确的是( )
①强电解质:氯化氢、氢氧化钡、摩尔盐 ②弱电解质:草酸、纯碱、醋酸铵
③非电解质:液氨、二氧化硫、苯 ④同系物:C2H4、C3H6、C5H10.
①强电解质:氯化氢、氢氧化钡、摩尔盐 ②弱电解质:草酸、纯碱、醋酸铵
③非电解质:液氨、二氧化硫、苯 ④同系物:C2H4、C3H6、C5H10.
| A、①②③ | B、①③ | C、①④ | D、②③ |
已知反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,下列说法不正确的是( )
| A、Cl2既是氧化剂又是还原剂 |
| B、被氧化的氯原子数是被还原的氯原子数的5倍 |
| C、氧化剂和还原剂的质量比是5:1 |
| D、NaCl是还原产物,NaClO3是氧化产物 |
下列离子方程式不正确的是( )
| A、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相混合均匀4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| B、向100mL0.1mol/L的碳酸钠溶液中逐滴加入0.1mol/L CH3COOH:CO32-+CH3COOH=CO2↑+2CH3COO-+H2O |
| C、向硫酸铝铵溶液中滴加过量的氢氧化钡溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
| D、KHS的水解:HS-+H2O?H2S+OH- |
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
| A、K+、Na+、HSO3-、NO3- |
| B、Na+、ClO-、SO42-、Cl- |
| C、NH4+、K+、SO42-、F- |
| D、Ag+、Na+、NO3-、CH3COOO- |
钢材可以用作桥梁的结构材料,是因为它( )
| A、有良好的导热性 |
| B、有一定的机械强度 |
| C、不易受空气和水的作用 |
| D、有良好的导电性 |
20℃时,H2S的饱和溶液1L,浓度约为1.0mol/L,其电离方程式为:第一步:H2S═H++HS-,第二步:HS-═H++S2-若使该溶液中c(H+)减小的同时c(S2-)也减小,可采用的措施是( )
| A、加入适量的NaOH |
| B、加入适量的水 |
| C、通入适量的SO2 |
| D、加入适量CuSO4固体 |
根据下列三个反应方程式,判断下列关系正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
| A、氧化性:FeCl3>Cl2>H2SO4>I2 |
| B、还原性:SO2>HI>FeCl2>HCl |
| C、2Fe+3I2=2FeI3 |
| D、6FeI2+3Cl2=2FeCl3+4FeI3 |