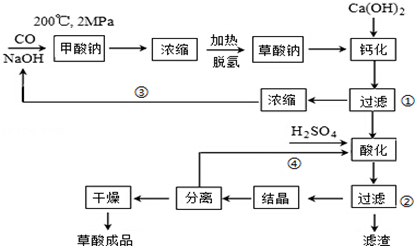
题目内容
16.亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:(一)鉴别NaCl和NaNO2
(1)测定溶液pH
用PH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示)
(2)沉淀法:取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两只试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.
该温度下Ksp(AgNO2)=2×10-8 Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{100}{9}$(计算结果写成分数).
(二)实验室可用如下装置(略去部分夹持仪器)备制亚硝酸钠.
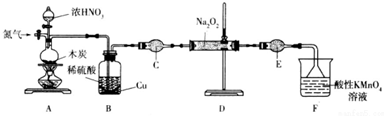
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置B的作用是吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体.仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(3)装置F中KMnO4溶液与NO发生反应的离子方程式为3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O.
分析 (一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(二)由制备亚硝酸钠的实验装置可知,先通入氮气,将装置中的空气排出,C与浓硝酸反应生成二氧化氮、二氧化碳,B中可除去二氧化氮,C为球形干燥管,干燥NO气体,D中发生2NO+Na2O2=2NaNO2,F为尾气处理,以此来解答.
解答 解:(一)(1)由于亚硝酸钠溶液中存在水解平衡:NO2-+H2O?HNO2+OH-,所以亚硝酸钠溶液显示碱性;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+),
故答案为:NO2-+H2O?HNO2+OH-;c(OH-)-c(H+);
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$,根据Ksp(AgCl)=c(Cl-)•c(Ag+)、Ksp(AgNO2)=c(NO2-)•c(Ag+)可知,K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgN{O}_{2})}{Ksp(AgCl)}$=$\frac{2×1{0}^{-8}}{1.8×1{0}^{-10}}$=$\frac{100}{9}$,
故答案为:$\frac{100}{9}$;
(二)由制备亚硝酸钠的实验装置可知,先通入氮气,将装置中的空气排出,C与浓硝酸反应生成二氧化氮、二氧化碳,B中可除去二氧化氮,C为球形干燥管,干燥NO气体,D中发生2NO+Na2O2=2NaNO2,F为尾气处理,
(1)由上述分析可知,加热装置A前,先通一段时间N2,目的是排出装置中的空气,
故答案为:排出装置中的空气;
(2)装置B的作用是吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体,仪器C的名称为干燥管,其中盛放的药品为碱石灰,
故答案为:吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体;干燥管; 碱石灰;
(3)装置F中酸性KMnO4溶液与NO发生反应的离子方程式为3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O,
故答案为:3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O.
点评 本题考查物质的制备实验及物质鉴别,为高频考点,把握制备实验原理、实验装置作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识、反应原理与实验相结合的训练,题目难度中等.

 阅读快车系列答案
阅读快车系列答案(1)二甲醚的核磁共振氢谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚的同分异构体A与浓硫酸混合,加热到170℃时生成有机物B:
①写出A的官能团电子式为
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;②德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应而获得1950年诺贝尔化学奖,该反应是一种环加成反应:凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一请根据以上信息写出2-甲基-1,3-丁二烯(含共轭双烯体系)与B反应化学方程式CH2=C(CH3)CH=CH2+CH2=CH2
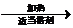
 .
.(3)二甲醚、空气、氢氧化钾溶液、多孔石墨电极构成燃料电池,则负极电极反应式是CH3OCH3+16OH--12e-=2CO32-+11H2O.
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
①比较此时正、逆反应速率的大小:v(正)> v(逆)(填“>”、“<”或“=”);
②若开始只加入CH3OH,经10min后反应达到平衡,计算达到平衡时CH3OH转化率 α(CH3OH)=96.8%(计算结果用百分数表示,保留小数后一位).
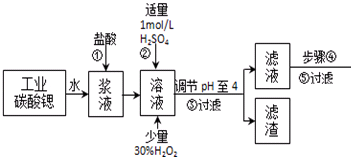
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
已知:
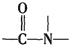 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$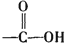 +
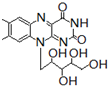
+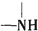 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: