题目内容
已知某溶液中存在较多的H+、NO3-,则该溶液中还可能大量存在的离子组是( )
| A、Mg2+、Fe2+、SO42- |
| B、Ba2+、NH4+、Br- |
| C、Al3+、HCO3-、Cl- |
| D、Na+、SiO32-、ClO- |
考点:离子共存问题
专题:离子反应专题
分析:根据离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应、不能相互促进水解等,则离子大量共存,以此来解答.
解答:
解:A.Fe2+、H+、NO3-发生氧化还原反应,不能共存,故A错误;
B.该组离子之间不反应,能大量共存,故B正确;
C.Al3+、HCO3-相互促进水解,H+、HCO3-结合生成水和气体,不能大量共存,故C错误;
D.因H+、SiO32-结合生成沉淀,H+、ClO-结合生成弱电解质,不能大量共存,故D错误;
故选:B.
B.该组离子之间不反应,能大量共存,故B正确;
C.Al3+、HCO3-相互促进水解,H+、HCO3-结合生成水和气体,不能大量共存,故C错误;
D.因H+、SiO32-结合生成沉淀,H+、ClO-结合生成弱电解质,不能大量共存,故D错误;
故选:B.
点评:本题考查离子的共存,为高考常见题型,侧重不同类型反应的考查,把握离子之间的反应即可解答,氧化还原反应、相互促进水解为解答的难点,题目难度不大.

练习册系列答案
相关题目
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、原氨水物质的量浓度为0.1 mol?L-1 |
| B、反应后的溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=0.1 mol?L-1 |
| C、反应后的溶液中:c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ) |
| D、原氨水中:c(NH4+)+c(H+)=c(OHˉ) |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、16g02和O3的混合气体所含氧原子数在NA/3到NA/2之间 |
| B、62g Na2O与78gNa202含有的离子数均为3NA |
| C、1molC5H12含共价键数为20NA |
| D、1LO.lmol/L的醋酸溶液中所含离子总数为0.2NA |
25℃时,下列各组离子在指定溶液中能大量共存的是( )
| A、滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO-2、Cl- | ||||
B、Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、Si
| ||||
C、含有较多S
| ||||
D、澄清透明溶液中:K+、Mn
|
当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀逐渐溶解成深蓝色溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀,将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色.根据实验现象推测,下列描述中正确的是( )
| A、蓝色沉淀为Cu(OH)2,深蓝色溶液中所含Cu2+浓度较大 |
| B、白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 |
| C、白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了氧化还原反应 |
| D、反应过程中消耗的SO2与生成的SO2的物相等 |
NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、9gD2O中含有的质子数为5NA |
| B、1molCaCl2中含有的离子数为3NA |
| C、30g甲醛中含共用电子对总数为4NA |
| D、71gCl2与足量NaOH溶液反应转移的电子数为2NA |
下列各组离子在所给条件下能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- |
| C、使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42- |
| D、溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH- |
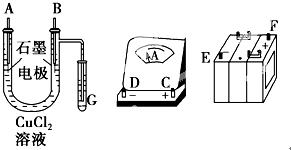 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为: