题目内容
已知A、B、C、D、E、F、G、H可以发生如图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.
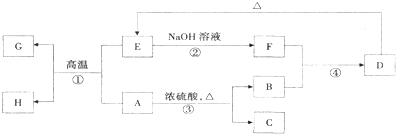
请填空:
(1)A在元素周期表的位置为: .
(2)请写出H的化学式为 .
(3)E的用途是 (任写一种均可).
(4)反应①的化学方程式是 .
(5)反应③的化学方程式是 .
(6)反应④的离子方程式是 .

请填空:
(1)A在元素周期表的位置为:
(2)请写出H的化学式为
(3)E的用途是
(4)反应①的化学方程式是
(5)反应③的化学方程式是
(6)反应④的离子方程式是
考点:无机物的推断,化学方程式的书写,离子方程式的书写
专题:推断题
分析:A为单质,在加热条件下可与浓硫酸反应生成两种气体,且化合物C是一种形成酸雨的大气污染物,则该反应为碳和浓硫酸的反应,生成CO2和SO2,则A为C,B为CO2,C为SO2,A、G为同一主族元素的单质,则G为Si,A与E的反应为2C+SiO2
2CO+Si,则E为SiO2,H为CO,F为Na2SiO3,D为H2SiO3,结合物质的性质和应用解答该题.
| ||
解答:
解:A为单质,在加热条件下可与浓硫酸反应生成两种气体,且化合物C是一种形成酸雨的大气污染物,则该反应为碳和浓硫酸的反应,生成CO2和SO2,则A为C,B为CO2,C为SO2,A、G为同一主族元素的单质,则G为Si,A与E的反应为2C+SiO2
2CO+Si,则E为SiO2,H为CO,F为Na2SiO3,D为H2SiO3,
(1)A为C,碳原子核外有6个电子,2个电子层,最外层有4个电子,所以碳元素位于第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)通过以上分析知,H为CO,故答案为:CO;
(3)E为SiO2,常用于制备玻璃、制粗硅、光导纤维等,故答案为:生产玻璃、制粗硅等;
(4)高温条件下,碳和二氧化硅反应生成硅和一氧化碳,反应方程式为 2C+SiO2
Si+2CO,
故答案为:2C+SiO2
Si+2CO;
(5)反应③为C和浓硫酸的反应,方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(6)反应④为Na2SiO3溶液和二氧化碳的反应,反应的方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-.
| ||
(1)A为C,碳原子核外有6个电子,2个电子层,最外层有4个电子,所以碳元素位于第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)通过以上分析知,H为CO,故答案为:CO;
(3)E为SiO2,常用于制备玻璃、制粗硅、光导纤维等,故答案为:生产玻璃、制粗硅等;
(4)高温条件下,碳和二氧化硅反应生成硅和一氧化碳,反应方程式为 2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(5)反应③为C和浓硫酸的反应,方程式为C+2H2SO4(浓)
| ||
| ||
(6)反应④为Na2SiO3溶液和二氧化碳的反应,反应的方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-.
点评:本题考查无机物的推断,以A与浓硫酸且生产导致酸雨的气体为突破口,答题时注意把握相关物质的性质及应用,注意碳和二氧化硅反应方程式的书写,生成物是一氧化碳不是二氧化碳,为易错点.

练习册系列答案
相关题目
已知断裂1mol F-F、Xe-F键需要吸收的能量分别为157kJ、130kJ,则Xe(g)+F2(g)═XeF2(g)的△H为( )
| A、+54 kJ?mo1-1 |
| B、-103 kJ?mo1-1 |
| C、+103 kJ?mo1-1 |
| D、不能确定 |
一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随稀释进行,下列数值一定增大的是(Kw表示水的离子积,Ka表示HA的电离常数)( )
| A、Kw | ||
B、
| ||
C、
| ||
| D、c(OH-) |
某无色溶液中一定能大量共存的是( )
| A、Cu2+、Cl-、NO3-、Na+ |
| B、Fe3+、K+、I-、Cl- |
| C、Al3+、SO42-、K+、Cl- |
| D、Ba2+、HCO3-、Na+、OH- |
已知某溶液中存在较多的H+、NO3-,则该溶液中还可能大量存在的离子组是( )
| A、Mg2+、Fe2+、SO42- |
| B、Ba2+、NH4+、Br- |
| C、Al3+、HCO3-、Cl- |
| D、Na+、SiO32-、ClO- |
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A、d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
| B、b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ |
| D、a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
下列说法正确的是( )
| A、常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) |
| B、常温下0.1 mol/L、pH为4的NaHB溶液中:c(HB-)c(H2B)>c(B2-) |
| C、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3?H2O④CH3COONH4中,c(NH+4)由大到小的顺序是:②>①>④>③ |
| D、常温下pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、6.89熔融的KHSO4中含有0.1NA个阳离子 |
| B、46 g NO2和N2O4混合气体中含有原子总数为3NA |
| C、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| D、标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |