题目内容
5.短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线;W、X两元素的族序数之差为3;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半.下列判断正确的是( )| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
分析 短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线,则W为O;W、X两元素的族序数之差为3,则X为Al;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半,则Y为Si,Z为Cl,然后结合元素化合物及元素周期律来解答.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线,则W为O;W、X两元素的族序数之差为3,则X为Al;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半,则Y为Si,Z为Cl,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子的半径大小:Z>W>X,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,则最高价氧化物对应水化物的酸性:Z>Y,故B错误;
C.W与Y形成的化合物为二氧化硅,不溶于水,故C错误;
D.X为Al,分别与酸、强碱反应均生成氢气,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素化合物性质、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
16.锂电池是近年发展起来的一种新型绿色电池,在通讯、医疗上具有广泛的应用,其总反应式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列说法正确的是( )
| A. | 电池的负极材料可选用多空隙的石墨 | |
| B. | 电池的正极反应为:3SOCl2+8e-═SO${\;}_{3}^{2-}$+2S+6Cl- | |
| C. | 电池的电解质溶液可选用稀盐酸 | |
| D. | 上述反应中,每转移4mol电子,生成氧化产物32g |
13.下列实验操作、现象和得出的结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
20.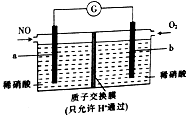 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
10.某实验小组探究工业上废渣(主要成分为Cu2S和Fe2O3)的综合利用,过程如下:
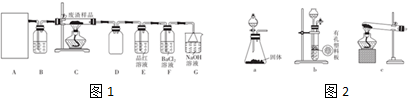
(1)该小组同学设计如图1装置模拟废渣在过量氧气中焙烧,并验证废渣中含有硫元素.
①在实验室中,图2装置可以作为装置A的是ac.
②证明废渣中含有硫元素的实验现象是装置E中品红溶液褪色.
③装置F中生成白色沉淀的离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(2)某同学将上述实验中灼烧后的固体A进行如下操作:
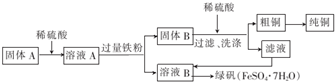
①固体B的成分是Fe、Cu(填化学式).
②由溶液B得到绿矾的过程中应该进行的操作是蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
③为测定产品中绿矾的质量分数,称取30.0g样品配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,反应为10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe(SO4)3+K2SO4+8H2O.实验所得数据如表所示.
Ⅰ.第1组实验数据出现异常,造成这种异常的原因可能是ac(填字母).
a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
Ⅱ.根据表中数据,产品中绿矾的质量分数为92.7%.

(1)该小组同学设计如图1装置模拟废渣在过量氧气中焙烧,并验证废渣中含有硫元素.
①在实验室中,图2装置可以作为装置A的是ac.
②证明废渣中含有硫元素的实验现象是装置E中品红溶液褪色.
③装置F中生成白色沉淀的离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(2)某同学将上述实验中灼烧后的固体A进行如下操作:

①固体B的成分是Fe、Cu(填化学式).
②由溶液B得到绿矾的过程中应该进行的操作是蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
③为测定产品中绿矾的质量分数,称取30.0g样品配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,反应为10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe(SO4)3+K2SO4+8H2O.实验所得数据如表所示.
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
Ⅱ.根据表中数据,产品中绿矾的质量分数为92.7%.
14.下列说法正确的是( )
| A. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| B. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| C. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| D. | 0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中c(OH-)都增大 |
15.下列说法不正确的是( )
| A. | 在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器 | |
| B. | 石墨烯是从石墨材料中剥离出来、由碳原子构成的只有一层原子厚度的二维晶体,该晶体属于烯烃类物质 | |
| C. | 生物质能来源于植物及其加工产品所贮存的能量,其主要利用形式有:直接燃烧、生物化学转化、热化学转换等 | |
| D. | 使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容 |
 (1)下列说法中,不正确的是DEHIJ
(1)下列说法中,不正确的是DEHIJ 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).