题目内容
16.锂电池是近年发展起来的一种新型绿色电池,在通讯、医疗上具有广泛的应用,其总反应式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列说法正确的是( )| A. | 电池的负极材料可选用多空隙的石墨 | |
| B. | 电池的正极反应为:3SOCl2+8e-═SO${\;}_{3}^{2-}$+2S+6Cl- | |
| C. | 电池的电解质溶液可选用稀盐酸 | |
| D. | 上述反应中,每转移4mol电子,生成氧化产物32g |
分析 A.锂的化合价升高,失去电子作负极;
B.电池的正极是SOCl2得到电子发生还原反应;
C.电池产物中有Li2SO3,稀盐酸会与Li2SO3反应产生SO2;
D.S是还原产物,不是氧化产物.
解答 解:A.锂的化合价升高,失去电子作负极,故A错误;
B.电池的正极是SOCl2得到电子发生还原反应,电极反应式为:3SOCl2+8e-═SO${\;}_{3}^{2-}$+2S+6Cl-,故B正确;
C.电池产物中有Li2SO3,稀盐酸会与Li2SO3反应产生SO2,故C错误;
D.SOCl2中S的化合价为+4价,降到0价,化合价降低得到的是还原产物,S是还原产物,不是氧化产物,故D错误;
故选B.
点评 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.

练习册系列答案
相关题目
13.下列方法不能达到预期目的是( )
| A. | 用KMnO4酸性溶液鉴别乙烯和CO2 | |
| B. | 用pH试纸鉴别NaCl溶液与HCl溶液 | |
| C. | 用观察外观颜色的方法区别铜板和铝板 | |
| D. | 用KOH溶液鉴别Na2CO3和KNO3溶液 |
14.A、B、C三支试管中分别盛有Cl-、Br-、I-的溶液.向试管A中加入淀粉溶液和新制氯水,溶液变成棕黄色;再将此溶液倒入试管C中,无明显现象.A、B、C三支试管中所含有的离子依次是( )
| A. | I-、Br-、Cl- | B. | Br-、Cl-、I- | C. | Cl-、I-、Br- | D. | Br-、I-、Cl- |
4.下列各组有机物的结构表达式中,互为同分异构体的是( )
| A. | 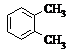 和 和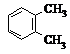 | B. | 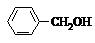 和 和 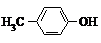 | C. |  和 和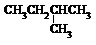 | D. | 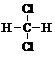 和 和 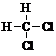 |
11.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
1.以锌锰废电池剖开、筛分得到的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料,回收MnSO4•H2O的工艺流程如下:
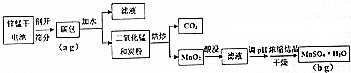
表1 酸的种类对浸取率的影响
表2 酸的浓度对浸取率的影响
(1)为提高黑色混合物的溶解速率,可采取的措施有粉碎碳包、升高温度、不断搅拌等.
(2)烘炒MnO2和炭粉的混合物,用到的操作为B(填写选项序号).
(3)①根据表中信息,可推知,酸浸步骤中,选择的酸的种类为硫酸,理由是磷酸的浸取率最低,而硫酸、盐酸、硝酸的浸取率差不多,硫酸稍高一点,且本实验要制取硫酸锰;
②酸的浓度对浸取率也有影响,从表中信息可知,应选择酸的浓度为1:1;
③酸浸过程中,常加入铝粉作还原剂,原因是3MnO2+12H++2Al=2Al3++3Mn2++6H2O(用离子方程式表示).
(4)调pH时,请根据表格数据选择pH的调节范围:5.2≤PH<7.8.
(5)Zn(OH)2也可以在NaOH溶液中溶解,离子方程式为Zn(OH)2+2OH-=ZnO22-+2H2O;
(6)碳包中二氧化锰平均含量为33%,则锰的回收率表达式为$\frac{87b}{169×0.33a}$×100%.

表1 酸的种类对浸取率的影响
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
(2)烘炒MnO2和炭粉的混合物,用到的操作为B(填写选项序号).

(3)①根据表中信息,可推知,酸浸步骤中,选择的酸的种类为硫酸,理由是磷酸的浸取率最低,而硫酸、盐酸、硝酸的浸取率差不多,硫酸稍高一点,且本实验要制取硫酸锰;
②酸的浓度对浸取率也有影响,从表中信息可知,应选择酸的浓度为1:1;
③酸浸过程中,常加入铝粉作还原剂,原因是3MnO2+12H++2Al=2Al3++3Mn2++6H2O(用离子方程式表示).
(4)调pH时,请根据表格数据选择pH的调节范围:5.2≤PH<7.8.
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
(6)碳包中二氧化锰平均含量为33%,则锰的回收率表达式为$\frac{87b}{169×0.33a}$×100%.
8.下列化学用语和描述均正确的是( )
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
5.短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线;W、X两元素的族序数之差为3;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半.下列判断正确的是( )
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
6.建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
| A. | 将汽油标准由“国IV”提到“国V”,以降低汽车尾气污染 | |
| B. | 积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 | |
| C. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| D. | 加高烟囱,减少烟尘对周围环境的影响 |