题目内容
13.下列实验操作、现象和得出的结论均正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁离子水解为吸热反应;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性溶液中,且淀粉遇碘变蓝;
C.向硝酸银溶液中滴加过量氨水,生成银氨络离子;
D.向饱和BaCO3溶液中加入BaSO4固体,Qc(BaCO3)>Ksp(BaCO3).
解答 解:A.铁离子水解生成胶体,则由操作和现象可知,温度升高,Fe3+的水解程度增大,水解反应为吸热反应,故A正确;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性溶液中,且淀粉遇碘变蓝,没有检验是否存在淀粉,不能确定淀粉水解程度,故B错误;
C.向硝酸银溶液中滴加过量氨水,生成银氨络离子,滴加过程中先生成白色沉淀,后溶解,现象不合理,故C错误;
D.向饱和BaCO3溶液中加入BaSO4固体,Qc(BaCO3)>Ksp(BaCO3),则生成碳酸钡沉淀,再加盐酸有气体,结论不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握盐类水解、沉淀的转化、物质的性质、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.海水蕴藏着丰富的资源.下列有关海水综合利用的说法中,不正确的是( )
| A. | 从海水中可提取食盐 | B. | 海水蒸馏可得淡水 | ||
| C. | 直接电解海水可得镁 | D. | 从海水中可提取溴 |
4.下列各组有机物的结构表达式中,互为同分异构体的是( )
| A. | 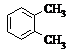 和 和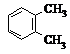 | B. | 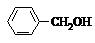 和 和 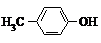 | C. |  和 和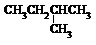 | D. | 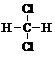 和 和 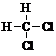 |
1.以锌锰废电池剖开、筛分得到的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料,回收MnSO4•H2O的工艺流程如下:
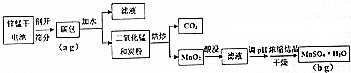
表1 酸的种类对浸取率的影响
表2 酸的浓度对浸取率的影响
(1)为提高黑色混合物的溶解速率,可采取的措施有粉碎碳包、升高温度、不断搅拌等.
(2)烘炒MnO2和炭粉的混合物,用到的操作为B(填写选项序号).
(3)①根据表中信息,可推知,酸浸步骤中,选择的酸的种类为硫酸,理由是磷酸的浸取率最低,而硫酸、盐酸、硝酸的浸取率差不多,硫酸稍高一点,且本实验要制取硫酸锰;
②酸的浓度对浸取率也有影响,从表中信息可知,应选择酸的浓度为1:1;
③酸浸过程中,常加入铝粉作还原剂,原因是3MnO2+12H++2Al=2Al3++3Mn2++6H2O(用离子方程式表示).
(4)调pH时,请根据表格数据选择pH的调节范围:5.2≤PH<7.8.
(5)Zn(OH)2也可以在NaOH溶液中溶解,离子方程式为Zn(OH)2+2OH-=ZnO22-+2H2O;
(6)碳包中二氧化锰平均含量为33%,则锰的回收率表达式为$\frac{87b}{169×0.33a}$×100%.

表1 酸的种类对浸取率的影响
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
(2)烘炒MnO2和炭粉的混合物,用到的操作为B(填写选项序号).

(3)①根据表中信息,可推知,酸浸步骤中,选择的酸的种类为硫酸,理由是磷酸的浸取率最低,而硫酸、盐酸、硝酸的浸取率差不多,硫酸稍高一点,且本实验要制取硫酸锰;
②酸的浓度对浸取率也有影响,从表中信息可知,应选择酸的浓度为1:1;
③酸浸过程中,常加入铝粉作还原剂,原因是3MnO2+12H++2Al=2Al3++3Mn2++6H2O(用离子方程式表示).
(4)调pH时,请根据表格数据选择pH的调节范围:5.2≤PH<7.8.
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
(6)碳包中二氧化锰平均含量为33%,则锰的回收率表达式为$\frac{87b}{169×0.33a}$×100%.
8.下列化学用语和描述均正确的是( )
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
18.香叶醛(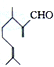 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(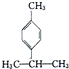 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
5.短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线;W、X两元素的族序数之差为3;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半.下列判断正确的是( )
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
2.设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
3.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是SO2.
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②产生红棕色气体的化学方程式是2NO+O2═2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是SO2.
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
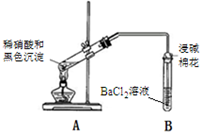 | 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现红棕色气体 3B试管中出现白色沉淀 |
②产生红棕色气体的化学方程式是2NO+O2═2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.