题目内容
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列有关说法正确的是( )
①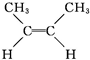 (g)?
(g)?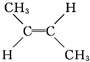 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1
顺-2-丁烯 反-2-丁烯
②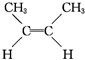 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
①
 (g)?
(g)? (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1顺-2-丁烯 反-2-丁烯
②
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为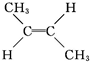 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
考点:反应热和焓变
专题:
分析:A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.根据热化学方程式计算热量;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
B.若生成物相同,反应物的能量高,则放出的热量多;
C.根据热化学方程式计算热量;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答:
解:A.物质本身具有的能量越高,越不稳定,燃烧放出的热量越大,由①可知,顺-2-丁烯具有的能量大于反-2-丁烯,反-2-丁烯比顺-2-丁烯稳定,故A错误;
B.由①可知,顺-2-丁烯具有的能量大于反-2-丁烯,燃烧放出的热量越大,故B错误;
C.28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为
kJ,故C错误;
D.②-①得: (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9 kJ?mol-1-(-4.2 kJ?mol-1)=-112.7 kJ?mol-1,故D正确;
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9 kJ?mol-1-(-4.2 kJ?mol-1)=-112.7 kJ?mol-1,故D正确;
故选D.
B.由①可知,顺-2-丁烯具有的能量大于反-2-丁烯,燃烧放出的热量越大,故B错误;
C.28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为
| 118.9 |
| 2 |
D.②-①得:
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9 kJ?mol-1-(-4.2 kJ?mol-1)=-112.7 kJ?mol-1,故D正确;
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9 kJ?mol-1-(-4.2 kJ?mol-1)=-112.7 kJ?mol-1,故D正确;故选D.
点评:本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.

练习册系列答案
相关题目
将等物质的量的镁和铝混合均匀,分成四等份,分别回到下列四种过量的溶液中,充分反应后,放出氢气最多的是( )
| A、3mol/LHCl溶液 |
| B、4mol/LHNO3溶液 |
| C、8mol/LNaOH溶液 |
| D、18mol/LH2SO4溶液 |
VmL密度为ρ g?mL-1的某溶液,含有相对分子质量为 M 的溶质m g,该溶液中溶质的质量分数为ω,物质的量浓度为c mol?L-1,则下列关系式正确的是( )
A、m=
| ||
B、c=
| ||
C、ω=
| ||
D、c=
|
25℃时,向VmLpH=a的硫酸中滴加10V mL pH=b的NaOH溶液时,溶液中SO42-的物质的量恰好等于加入的Na+的物质的量的
,则a+b的值为( )
| 1 |
| 2 |
| A、13 | B、14 |
| C、15 | D、不能确定 |
需要加入还原剂才能使下列离子反应发生的是( )
| A、MnO4-~Mn2+ |
| B、Br-~Br2 |
| C、CO32-~CO2 |
| D、S2-~S |
某元素X所形成的分子X2共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是( )
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
酱油中氯丙醇的超标问题一直备受世人关注,在氯丙醇家族中有一种三氯丙醇(分子中只含一个羟基),三氯丙醇有多种同分异构体,其中羟基和氯原子不在同一个碳原子上的异构体有(不考虑立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列两种气体的分子数一定相等的是( )
| A、质量相等而密度不等的N2和CO |
| B、等体积、等密度的CO和NO |
| C、等温、等体积的N2 和O2 |
| D、等压、等体积的N2和CO2 |
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应: