题目内容
25℃时,向VmLpH=a的硫酸中滴加10V mL pH=b的NaOH溶液时,溶液中SO42-的物质的量恰好等于加入的Na+的物质的量的
,则a+b的值为( )
| 1 |
| 2 |
| A、13 | B、14 |
| C、15 | D、不能确定 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:依据此温度下离子积Kw=c(H+)c(OH-)=10-14mol?L-1,该温度下向 VmLpH=a 的H2SO4 溶液中加入pH=b 的NaOH溶液 10VmL 时,溶液中的 SO42- 的物质的量恰好等于加入的 Na+的物质的量的一半,结合元素物质的量定量关系计算分析.
解答:
解:溶液中S
的物质的量恰好等于加入的Na+的物质的量的
,说明恰好完全反应,溶液呈中性,即V mL×10-3×10-a mol?L-1=10V mL×10-3×10b-14 mol?L-1,解得a+b=13.
故选A.
| O | 2- 4 |
| 1 |
| 2 |
故选A.
点评:本题考查了酸碱混合后溶液PH的计算应用,注意离子积常数的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列装置所示的实验中,能达到实验目的是( )

| A、分离碘酒中的碘和酒精 |
| B、排水集气法收集NO气体 |
| C、配制100mL NaCl溶液 |
| D、实验室制取干燥的氨气 |
下列叙述正确的是( )
| A、氢氧化钠的摩尔质量是40g |
| B、1mol NaOH的质量是40g/mol |
| C、1g H2和1g N2所含分子数相等 |
| D、等质量的N2、CH4、CO、H2O中CH4所含分子数最多 |
某元素X的相对原子质量为a,它的最高价氧化物的水化物的化学式为HmXOn(m>1).下列有关叙述中一定正确的是( )
| A、该酸的水溶液中c(H+):c(XOnm-)=n:1 |
| B、该酸的摩尔质量为(m+a+16n)g |
| C、100mL该酸溶液,只能中和4gNaOH |
| D、若0.1molL-1该酸溶液的pH=1,则NamXOn的水溶液的pH>7 |
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列有关说法正确的是( )
①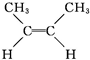 (g)?
(g)?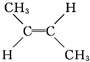 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1
顺-2-丁烯 反-2-丁烯
②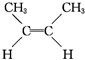 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
①
 (g)?
(g)? (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1顺-2-丁烯 反-2-丁烯
②
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为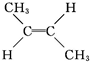 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
现有浓度均为0.10mo1?L-1的①Na2CO3溶液和②NaHCO3溶液.下列说法不正确的是( )
| A、①中有:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、①溶液的pH大于②溶液的pH |
| C、①和②混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、①或②中都有:c(HCO3-)+c(CO32-)+c(H2CO3)=0.10 mol?L-1 |
