题目内容
将等物质的量的镁和铝混合均匀,分成四等份,分别回到下列四种过量的溶液中,充分反应后,放出氢气最多的是( )
| A、3mol/LHCl溶液 |
| B、4mol/LHNO3溶液 |
| C、8mol/LNaOH溶液 |
| D、18mol/LH2SO4溶液 |
考点:铝的化学性质,镁的化学性质,有关混合物反应的计算
专题:计算题
分析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应,而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多.
解答:
解:A、盐酸为非氧化性酸,等物质的量的镁和铝都能和盐酸反应生成氢气;
B、硝酸为氧化性酸,与镁、铝反应不会生成氢气;
C、镁不能和氢氧化钠反应,铝和氢氧化钠反应生成氢气;
D、镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);
有以上分析可知:加入盐酸,等物质的量的镁和铝都与盐酸反应产生氢气,所以氢气量最多.
故选A.
B、硝酸为氧化性酸,与镁、铝反应不会生成氢气;
C、镁不能和氢氧化钠反应,铝和氢氧化钠反应生成氢气;
D、镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);
有以上分析可知:加入盐酸,等物质的量的镁和铝都与盐酸反应产生氢气,所以氢气量最多.
故选A.
点评:本题考查金属的性质,较易题.主要考查学生运用所学化学知识综合分析和解决实际问题的能力,该题溶液的浓度不是计算的数据,而是判断溶液属于“浓”或是“稀”,8mol/L以上的HCl、H2SO4、HNO3通常认为是浓酸.

练习册系列答案
相关题目
如下是某物质的合成流程图,从A到最终产物需经过四步反应,第1、2、4步反应的反应类型正确的一项是

A
 ( )
( )

| NaOH溶液 |
| 一定条件 |
| 1 |
| 2 |
| 3 |
| 4 |
 ( )
( )| A、酯化反应、氧化反应、氧化反应 |
| B、氧化反应、氧化反应、酯化反应 |
| C、氧化反应、取代反应、氧化反应 |
| D、酯化反应、氧化反应、氧化反应 |
下列装置所示的实验中,能达到实验目的是( )

| A、分离碘酒中的碘和酒精 |
| B、排水集气法收集NO气体 |
| C、配制100mL NaCl溶液 |
| D、实验室制取干燥的氨气 |
煤或石油的加工方法中,可用于大量获取乙烯和丙烯的是( )
| A、煤的干馏 |
| B、重油裂解 |
| C、石油减压分馏 |
| D、石油常压分馏 |
已达到平衡状态的下列可逆反应中,降低温度,体系的颜色会变深的是( )
| A、2NO2(g)?N2O4(g)△H<0 |
| B、2NO2(g)?2NO(g)+O2(g)△H>0 |
| C、2HBr(g)?H2(g)+Br2(g)△H>0 |
| D、3NO2(g)+H2O(l)?2HNO3(l)+NO(g)△H<0 |
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列有关说法正确的是( )
①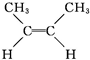 (g)?
(g)?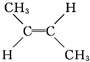 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1
顺-2-丁烯 反-2-丁烯
②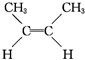 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
①
 (g)?
(g)? (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1顺-2-丁烯 反-2-丁烯
②
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为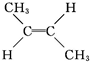 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
 甲烷的取代反应实验(如图)CH4+Cl2→CH3Cl+HCl
甲烷的取代反应实验(如图)CH4+Cl2→CH3Cl+HCl