题目内容
下列两种气体的分子数一定相等的是( )
| A、质量相等而密度不等的N2和CO |
| B、等体积、等密度的CO和NO |
| C、等温、等体积的N2 和O2 |
| D、等压、等体积的N2和CO2 |
考点:阿伏加德罗定律及推论
专题:
分析:两种气体的分子数一定相等,根据N=nNA可知,二者物质的量相等,
A.根据n=
判断;
B.根据m=ρV、n=
判断;
C.根据PV=nRT,可知温等体积下压强影响气体物质的量;
D.根据PV=nRT,可知等压等体积下温度影响气体物质的量.
A.根据n=
| m |
| M |
B.根据m=ρV、n=
| m |
| M |
C.根据PV=nRT,可知温等体积下压强影响气体物质的量;
D.根据PV=nRT,可知等压等体积下温度影响气体物质的量.
解答:
解:两种气体的分子数一定相等,根据N=nNA可知,二者物质的量相等,
A.N2和CO的摩尔质量都是28g/mol,二者质量相等,根据n=
可知二者物质的量相等,故A正确;
B.等体积、等密度的CO和NO,根据m=ρV可知二者质量相等,但二者摩尔质量不相等,再根据n=
可知物质的量不等,含有分子数目不相等,故B错误;
C.根据PV=nRT可知,等温等体积下影响气体物质的量的因素为压强,二者压强不一定相等,故含有分子数目不一定相等,故C错误;
D.根据PV=nRT可知,等压等体积下影响气体物质的量的因素为温度,二者温度不一定相等,故含有分子数目不一定相等,故D错误,
故选A.
A.N2和CO的摩尔质量都是28g/mol,二者质量相等,根据n=
| m |
| M |
B.等体积、等密度的CO和NO,根据m=ρV可知二者质量相等,但二者摩尔质量不相等,再根据n=
| m |
| M |
C.根据PV=nRT可知,等温等体积下影响气体物质的量的因素为压强,二者压强不一定相等,故含有分子数目不一定相等,故C错误;
D.根据PV=nRT可知,等压等体积下影响气体物质的量的因素为温度,二者温度不一定相等,故含有分子数目不一定相等,故D错误,
故选A.
点评:本题考查阿伏伽德罗定律及推论,为高频考点,把握pV=nRT理解阿伏伽德罗定律及推论为解答的关键,侧重分析与应用能力的考查,注意气体体积与温度、压强有关,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列有关说法正确的是( )
①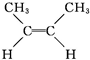 (g)?
(g)?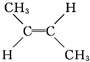 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1
顺-2-丁烯 反-2-丁烯
②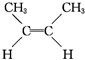 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
①
 (g)?
(g)? (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1顺-2-丁烯 反-2-丁烯
②
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为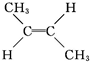 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
现有浓度均为0.10mo1?L-1的①Na2CO3溶液和②NaHCO3溶液.下列说法不正确的是( )
| A、①中有:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、①溶液的pH大于②溶液的pH |
| C、①和②混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、①或②中都有:c(HCO3-)+c(CO32-)+c(H2CO3)=0.10 mol?L-1 |
金属键的形成是通过( )
| A、金属原子与自由电子之间的相互作用 |
| B、金属离子与自由电子之间强烈的相互作用 |
| C、自由电子之间的相互作用 |
| D、金属离子之间的相互作用 |
下列说法正确的是( )
| A、氮氧化物的大量排放是造成光化学烟雾的主要原因 |
| B、检查病人胃病所用的钡餐,既可以用BaSO4,也可以用BaCO3 |
| C、浓硫酸不可用来干燥NH3,因其具有强氧化性 |
| D、雨水样品放置一段时间后,pH由4.68变为4.28,是因为溶解了较多的氮氧化物和CO2 |
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.

 的反应条件是
的反应条件是 )是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol?L-1KMnO4溶液并不断振荡.下列哪一种试剂最适合用来溶解环戊烯做此实验( )
)是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol?L-1KMnO4溶液并不断振荡.下列哪一种试剂最适合用来溶解环戊烯做此实验( )