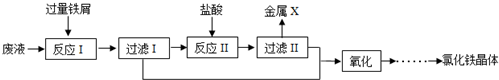
题目内容
16.铁是人体必须的微量元素,在化学中也有重要的作用.Ⅰ.已知实验室由草酸亚铁晶体(FeC2O4•2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合可制得工业催化剂K3[Fe(C2O4)3]•3H2O(翠绿色晶体),该晶体在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2和H2O.
请回答下列问题:
(1)制备过程要防止草酸被H2O2氧化,草酸被H2O2氧化的化学方程式为H2C2O4+H2O2═2CO2↑+2H2O.
(2)上述实验中制备配K3[Fe(C2O4)3]•3H2O的反应方程式为2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]•3H2O.
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3?[Cu(NH3)4]2+,其稳定常数表达式为:k=$\frac{c[Cu(N{H}_{3})_{4}^{2+}]}{c(C{u}^{2+})•{c}^{4}(N{H}_{3})}$.已知K[Fe(C2O4)33-]=1020,K[Fe(SCN)3]=2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]•3H2O中的铁元素?否(填“是”、“否”). 若选“否”,请设计检验铁元素的方案取适量晶体加热至分解;取分解后的固体残留物适量溶解在稀H2SO4中;取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无.
Ⅱ.FeSO4•7H2O也叫绿矾,是治疗缺铁性贫血药品的主要成分.
(4)治疗贫血的药片上涂有糖衣,目的是隔绝空气,防止被氧化.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取5.7g绿矾产品,配制成250mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为40.00mL.(滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O).
①滴定到终点的标志是当最后一滴酸性高锰酸钾溶液滴入锥形瓶,溶液恰好由棕黄色变成浅紫红色时,且半分钟内不恢复,说明达到终点.
②计算上述样品中FeSO4•7H2O的质量分数为97.54%.
分析 (1)草酸被H2O2氧化生成水和二氧化碳;
(2)由草酸亚铁晶体(FeC2O4•2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合可制K3[Fe(C2O4)3]•3H2O,此反应为非氧化还原反应,只需要结合原子守恒配平即可;
(3)K3[Fe(C2O4)3]•3H2O中的铁为亚铁离子,而铁离子遇KSCN溶液变为血红色;
(4)FeSO4•7H2O俗称绿矾,是治疗缺铁性贫血的主要成分,FeSO4具有还原性,应隔绝空气保存;
(5)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到.
解答 解:(1)草酸被H2O2氧化生成水和二氧化碳,该反应为H2C2O4+H2O2=2CO2↑+2H2O,故答案为:H2C2O4+H2O2=2CO2↑+2H2O;
(2)根据原子守恒,草酸亚铁晶体(FeC2O4•2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合可制K3[Fe(C2O4)3]•3H2O的反应方程式为2FeC2O4•2H2O+H2O2+3 K2C2O4+H2C2O4═2 K3[Fe(C2O4)3]•3H2O,故答案为:2FeC2O4•2H2O+H2O2+3 K2C2O4+H2C2O4═2 K3[Fe(C2O4)3]•3H2O;
(3)K3[Fe(C2O4)3]•3H2O中的铁为亚铁离子,则不能用KSCN溶液检验K3[Fe(C2O4)3]•3H2O中的铁元素,检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无,故答案为:否;取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;
(4)FeSO4具有还原性,应隔绝空气保存,防止被氧化,故答案为:隔绝空气,防止被氧化;
(5)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点,
故答案为:当滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为40.00mL;
依据反应方程式进行计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0400L
计算得到;n(Fe2+)=0.002mol;
则250mL溶液中含Fe2+=0.002mol×$\frac{250}{25}$=0.02mol;
FeSO4•7H2O物质的量为0.02mol,质量=0.02mol×278g/mol=5.56g;
质量分数=$\frac{5.56g}{5.7g}$×100%=97.54%,
故答案为:97.54%.
点评 本题考查知识点较多,涉及反应的配平、氧化还原反应、离子的检验及滴定终点的确定、离子方程式的计算,明确氧化还原反应和离子方程式是关键,题目难度中等,做文字叙述题目答题时要切中要点.

| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |
| A. | 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火 | |
| B. | 用石英制成光导纤维,由水玻璃制硅胶都是化学变化 | |
| C. | 火法炼铜、湿法炼铜都是置换反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
| A. | Y的氢化物的沸点比R的氢化物的沸点高 | |
| B. | Z、W、R按最高价氧化物对应水化物的酸性强弱排列顺序是R>W>Z | |
| C. | X2Y2化合物中的化学键与X2R中的化学键类型完全相同 | |
| D. | RY2通入Ba(NO3)2溶液中有白色沉淀生成,该沉淀不溶于硝酸 |
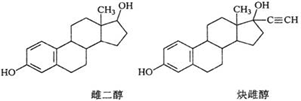
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |
 .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$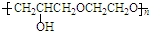 +nHCl
+nHCl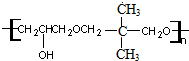 .
.