��Ŀ����
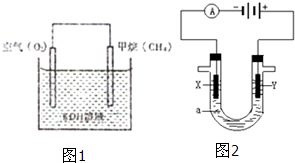 �ں�����ظ�ԭ����������Ϊ����ȼ�����Ļ���������Դ����Ҫ�ɷ���CH4��CH4�ڹ����¿���Cl2��Ӧ��Ҳ������CH4��H2OΪԭ���Ʊ������Ѻͼ״�������ȼ�ϣ�
�ں�����ظ�ԭ����������Ϊ����ȼ�����Ļ���������Դ����Ҫ�ɷ���CH4��CH4�ڹ����¿���Cl2��Ӧ��Ҳ������CH4��H2OΪԭ���Ʊ������Ѻͼ״�������ȼ�ϣ���1����һ�������£�������Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g����H��0��
����2L����㶨���ܱ������з�����Ӧ��T��ʱ��ͨ��2molCH4��g����2mol H2O��g������Ӧ��ƽ�������l molCO��CH4��ת����Ϊ
��2��CH4���������ȼ�ϵ�أ�����ȼ�ϵ�صĹ���ԭ����ͼ1��ʾ��ͨ��CH4��һ���缫��ӦʽΪ��
��3������CH4ȼ�ϵ����ͼ2��ʾ�ĵ���������U�ι�װ�е��Һa��X��Y������缫�壬��ش��������⣺
�ٸõ��ص�Y�缫��CH4ȼ�ϵ����ͨ��
����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ���������X���ϵĵ缫��ӦΪ
�õ��ص��ܷ�ӦΪ
����X��Y���Ƕ��Ե缫��a�Ǻ���0.4mol CuSO4��0.2mol KCl��ˮ��Һ1L�����һ��ʱ�����һ���缫������18.2g Cu����ʱ����һ�缫�Ϸų��������ڱ�״���µ����
���㣺��ѧƽ��ļ���,��ѧ��Դ���͵��,��ѧƽ���Ӱ������
ר�⣺�����������������
��������1����2L����㶨���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ӧ��ƽ���ʱ����
CH4��g��+H2O��g��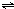 CO��g��+3H2��g��
CO��g��+3H2��g��
��ʼ��mol/L�� 1 1 0 0
��Ӧ��mol/L�� 0.5 0.5 0.5 1.5
ƽ�⣨mol/L�� 0.5 0.5 0.5 1.5
����CH4��ת����=
��100%=50%��
����ƽ�ⳣ��K=
=6.75��
ƽ�ⳣ��ֻ���¶��йأ������ʵ���ʼŨ���أ����Դ�ʱ����1mol CH4��g����1mol H2O��g��1mol CO��3molH2�Ļ�����壨�����¶Ȳ��䣩���պô����ݾ���������ƽ��״̬����ƽ�ⲻ�ƶ���ƽ�ⳣ����ȻΪ6.75��
����2L����ɱ���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ϊ��Ӧʱ�������������2L����ɱ���ܱ������з�����Ӧ�൱�ڼ�ѹ��ƽ��Ҫ������Ӧ�����ƶ�����Ӧ��ƽ�������CO����l mol��
��2�����������õ����ӻ��ϼ���������д�������ܷ�Ӧʽ�ж���Һ��PH�仯��
��3���ٸ��ݵ��ص�������ԭ��ص�����������������ԭ��صĸ��������жϣ�
����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��Y�缫�������ӷŵ�����������X�缫�������ӷŵ磬ͬʱ�õ缫�����������������ӣ�
��n��Cu��=
=0.28mol����������Cu2++2e-=Cu����֪�����õ�0.56mol���ӣ�����������2Cl--2e-=Cl2����4OH--4e-=O2��+2H2O���������ת�Ƶ�����Ŀ��Ⱥ͵缫����ʽ���㣮
CH4��g��+H2O��g��
 CO��g��+3H2��g��
CO��g��+3H2��g����ʼ��mol/L�� 1 1 0 0
��Ӧ��mol/L�� 0.5 0.5 0.5 1.5
ƽ�⣨mol/L�� 0.5 0.5 0.5 1.5
����CH4��ת����=
| 0.5 |
| 1 |
����ƽ�ⳣ��K=
| 1.5 3��0.5 |
| 0.5��0.5 |
ƽ�ⳣ��ֻ���¶��йأ������ʵ���ʼŨ���أ����Դ�ʱ����1mol CH4��g����1mol H2O��g��1mol CO��3molH2�Ļ�����壨�����¶Ȳ��䣩���պô����ݾ���������ƽ��״̬����ƽ�ⲻ�ƶ���ƽ�ⳣ����ȻΪ6.75��
����2L����ɱ���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ϊ��Ӧʱ�������������2L����ɱ���ܱ������з�����Ӧ�൱�ڼ�ѹ��ƽ��Ҫ������Ӧ�����ƶ�����Ӧ��ƽ�������CO����l mol��
��2�����������õ����ӻ��ϼ���������д�������ܷ�Ӧʽ�ж���Һ��PH�仯��
��3���ٸ��ݵ��ص�������ԭ��ص�����������������ԭ��صĸ��������жϣ�
����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��Y�缫�������ӷŵ�����������X�缫�������ӷŵ磬ͬʱ�õ缫�����������������ӣ�
��n��Cu��=
| 18.2g |
| 64g/mol |
���
�⣺��1����2L����㶨���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ӧ��ƽ���ʱ����
CH4��g��+H2O��g�� CO��g��+3H2��g��
CO��g��+3H2��g��
��ʼ��mol/L�� 1 1 0 0
��Ӧ��mol/L�� 0.5 0.5 0.5 1.5
ƽ�⣨mol/L�� 0.5 0.5 0.5 1.5
����CH4��ת����=
��100%=50%��
����ƽ�ⳣ��K=
=6.75��
ƽ�ⳣ��ֻ���¶��йأ������ʵ���ʼŨ���أ����Դ�ʱ����1mol CH4��g����1mol H2O��g��1mol CO��3molH2�Ļ�����壨�����¶Ȳ��䣩���պô����ݾ���������ƽ��״̬����ƽ�ⲻ�ƶ���ƽ�ⳣ����ȻΪ6.75��
����2L����ɱ���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ϊ��Ӧʱ�������������2L����ɱ���ܱ������з�����Ӧ�൱�ڼ�ѹ��ƽ��Ҫ������Ӧ�����ƶ�����Ӧ��ƽ�������CO����l mol��
�ʴ�Ϊ��50%������6.75�����ڣ�
��2��CH4ʧȥ����ʧȥ���缫��ӦΪ��CH4-8e-+10OH-�TCO32-+7H2O���õ�صķ�ӦʽΪ2O2+CH4+2OH-�TCO32-+3H2O����������Һ�е����������ӣ������ܼ�ˮ���ɣ�������Һ�����������ӵ�Ũ�Ƚ��ͣ��ʴ�Ϊ��CH4-8e-+10OH-�TCO32-+7H2O�����ͣ�
��3���ٵ��ص�������ԭ��ص�����������������ԭ��صĸ���������Y�缫Ϊ������������CH4ȼ�ϵ����ͨ������һ���������ʴ�Ϊ��O2��
����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��Y�缫�������ӷŵ������������缫��ӦʽΪ2Cl--2e-=Cl2����X�缫�������ӷŵ磬�缫��ӦʽΪ2H++2e-=H2����ͬʱ�õ缫�����������������ӣ�Y�缫�������ӷŵ��������������Ե�ط�ӦʽΪ2NaCl+2H2O
2NaOH+Cl2��+H2�����ʴ�Ϊ��2H++2e-=H2����2NaCl+2H2O
2NaOH+Cl2��+H2����
��n��Cu��=
=0.28mol����������Cu2++2e-=Cu����֪�����õ�0.56mol���ӣ�����������2Cl--2e-=Cl2����4OH--4e-=O2��+2H2O��
������n��Cl2��=0.1mol��ת�Ƶ���0.2mol��
����������ת�Ƶ���0.36mol����������0.09mol��
��������������0.19mol���壬���Ϊ4.256L���ʴ�Ϊ��4.256L��
CH4��g��+H2O��g��
 CO��g��+3H2��g��
CO��g��+3H2��g����ʼ��mol/L�� 1 1 0 0
��Ӧ��mol/L�� 0.5 0.5 0.5 1.5
ƽ�⣨mol/L�� 0.5 0.5 0.5 1.5
����CH4��ת����=
| 0.5 |
| 1 |
����ƽ�ⳣ��K=
| 1.5 3��0.5 |
| 0.5��0.5 |
ƽ�ⳣ��ֻ���¶��йأ������ʵ���ʼŨ���أ����Դ�ʱ����1mol CH4��g����1mol H2O��g��1mol CO��3molH2�Ļ�����壨�����¶Ȳ��䣩���պô����ݾ���������ƽ��״̬����ƽ�ⲻ�ƶ���ƽ�ⳣ����ȻΪ6.75��
����2L����ɱ���ܱ������з�����Ӧ��T��ʱ��ͨ��2mol CH4��g����2mol H2O��g������Ϊ��Ӧʱ�������������2L����ɱ���ܱ������з�����Ӧ�൱�ڼ�ѹ��ƽ��Ҫ������Ӧ�����ƶ�����Ӧ��ƽ�������CO����l mol��
�ʴ�Ϊ��50%������6.75�����ڣ�
��2��CH4ʧȥ����ʧȥ���缫��ӦΪ��CH4-8e-+10OH-�TCO32-+7H2O���õ�صķ�ӦʽΪ2O2+CH4+2OH-�TCO32-+3H2O����������Һ�е����������ӣ������ܼ�ˮ���ɣ�������Һ�����������ӵ�Ũ�Ƚ��ͣ��ʴ�Ϊ��CH4-8e-+10OH-�TCO32-+7H2O�����ͣ�
��3���ٵ��ص�������ԭ��ص�����������������ԭ��صĸ���������Y�缫Ϊ������������CH4ȼ�ϵ����ͨ������һ���������ʴ�Ϊ��O2��
����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��Y�缫�������ӷŵ������������缫��ӦʽΪ2Cl--2e-=Cl2����X�缫�������ӷŵ磬�缫��ӦʽΪ2H++2e-=H2����ͬʱ�õ缫�����������������ӣ�Y�缫�������ӷŵ��������������Ե�ط�ӦʽΪ2NaCl+2H2O
| ||
| ||
��n��Cu��=
| 18.2g |
| 64g/mol |
������n��Cl2��=0.1mol��ת�Ƶ���0.2mol��
����������ת�Ƶ���0.36mol����������0.09mol��
��������������0.19mol���壬���Ϊ4.256L���ʴ�Ϊ��4.256L��
������������Ҫ�����˻�ѧƽ�ⳣ������ѧƽ���ƶ����缫��Ӧʽ����д��������ѧ���ķ��������ͼ��������Ŀ��飬ע����յ�ⷽ��ʽ����д��Ϊ������Ĺؼ����Ѷ��еȣ�

��ϰ��ϵ�д�
 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
�����Ŀ
ȼ��ij������壬��������CO2������һ������ȼ��ͬ������ϩ��������CO2���������û�������ǣ�������
| A����ϩ������ |
| B����Ȳ��C2H2������ϩ |
| C����Ȳ������ |
| D�����顢������ |
һԪ��HA��Һ�У�����һ����ǿ��MOH��Һ��ǡ����ȫ��Ӧ����Ӧ�����Һ�У������ж�һ����ȷ���ǣ�������
| A��c��A-���Rc��M+�� |
| B��c��A-��=c��M+�� |
| C����MA��ˮ�⣬��c��OH-����c��H+�� |
| D����MAˮ�⣬��c��OH-����c��H+�� |
��֪ij�¶���0.1moL/L��NaHB��Һ��c��H+����c��OH-���������й�ϵʽһ����ȷ���ǣ�������
| A��c��H+��+c��Na+��=c��HB-��+c��B2-��+c��OH-�� |
| B��c��Na+��=0.1 moL/L��c��B2-�� |
| C��c��H+����c��OH-��=1��10-14 |
| D����Һ��pH=1 |
NaCl��Һ�л���Na2S��NaI��Ϊ�˳�ȥ���ʣ�����������һ���룬ѡ�����²�����
��ͨ��Cl2���ڼӵ�ˮ������CCl4��ȡ���ܹ��ˣ��ݷ�Һ�������˳����ȷ���ǣ�������
��ͨ��Cl2���ڼӵ�ˮ������CCl4��ȡ���ܹ��ˣ��ݷ�Һ�������˳����ȷ���ǣ�������
| A���٢ڢۢܢ� |
| B���ڢܢ٢ۢ� |
| C���ܢݢۢڢ� |
| D���ݢڢ٢ܢ� |
���и����л�����������Ժ������ʵ����ı�����ͣ�ֻҪ�����ʵ���һ����������ȫȼ��ʱ��������������Ϊһ��ֵ���ǣ�������
| A��C2H6��C3H8 |
| B��C5H10��C6H6 |
| C��C2H6O��C2H4O2 |
| D��C4H8��C3H8O |
 �������������Դ�����Ѵ��ˣ��о����֣��Ͻ�����������������磨
�������������Դ�����Ѵ��ˣ��о����֣��Ͻ�����������������磨