题目内容
从下列事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| A | 常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 | 非金属性:P>N |
| B | CO2的水溶液可导电 | CO2是电解质 |
| C | SO2通入溴水溶液,溶液褪色 | SO2有漂白性 |
| D | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 同浓度溶液的pH:NaAlO2>NaHCO3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.比较非金属性的角度错误;
B.二氧化碳的水溶液导电是碳酸导电,不是二氧化碳本身导电;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质;
D.化学反应遵循强酸制弱酸的规律.
B.二氧化碳的水溶液导电是碳酸导电,不是二氧化碳本身导电;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质;
D.化学反应遵循强酸制弱酸的规律.
解答:
解:A.应用氢化物的稳定性或最高价氧化物的水化物的酸性比较,比较非金属性的角度错误,故A错误;
B.CO2的水溶液可导电是碳酸导电,二氧化碳属于非电解质,故B错误;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质,二氧化硫使溴水褪色,发生氧化还原反应,体现二氧化硫的还原性,故C错误;
D.化学反应遵循强酸制弱酸的规律,NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝,则证明酸性:HCO3->Al(OH)3,越弱越水解,pH越大,故D正确.
故选D.
B.CO2的水溶液可导电是碳酸导电,二氧化碳属于非电解质,故B错误;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质,二氧化硫使溴水褪色,发生氧化还原反应,体现二氧化硫的还原性,故C错误;
D.化学反应遵循强酸制弱酸的规律,NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝,则证明酸性:HCO3->Al(OH)3,越弱越水解,pH越大,故D正确.
故选D.
点评:本题考查化学实验方案的评价,涉及电解质、氧化还原反应、酸性以及非金属的比较,为高考常见题型,综合考查学生的实验评价和分析能力,题目难度不大,注意把握相关物质的性质.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是( )
| A、滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B、pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A、υ(A)=0.5 mol/(L?s) |
| B、υ(B)=0.3 mol/(L?s) |
| C、υ(C)=18 mol/(L?min) |
| D、υ(D)=1 mol/(L?s) |
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氢氧化钠 |
| D、澄清石灰水中通入过量CO2 |
下列物质属于电解质的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸⑧NH3?H2O ⑨三氧化硫.
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸⑧NH3?H2O ⑨三氧化硫.
| A、①②⑥⑧ | B、②⑤⑦⑧ |
| C、②⑤⑥⑦ | D、②④⑤⑨ |
下列物质与对应的性质或特性相符合的是( )
| A、水→在人体内调节酸碱度的主要物质 |
| B、油脂→发生水解反应得到氨基酸和甘油 |
| C、蔗糖→与氢氧化铜悬浊液反应生成砖红色沉淀 |
| D、纤维素→发生水解反应最终生成葡萄糖 |
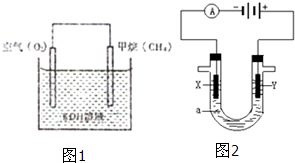 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.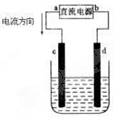 电解CuCl2溶液装置如图:(用惰性电极)电源的正极为
电解CuCl2溶液装置如图:(用惰性电极)电源的正极为