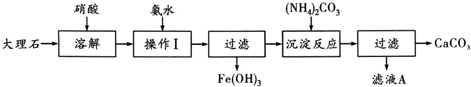
题目内容
一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断一定正确的是( )
| A、c(A-)≧c(M+) |
| B、c(A-)=c(M+) |
| C、若MA不水解,则c(OH-)<c(H+) |
| D、若MA水解,则c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:如果一元酸HA为强电解质,则两溶液恰好反应时溶液显示中性,c(A-)=c(M+);若HA为为弱电解质,二者恰好反应生成强碱弱酸盐MA,溶液显示碱性,c(A-)<c(M+);无论MA水解还是不水解,由于A-离子水解程度较小,都一定存在c( OH-)<c(A-),据此进行解答.
解答:
解:A、若一元酸HA为强电解质,则两溶液恰好反应时溶液显示中性,根据电荷守恒知:c(A-)=c(M+);若HA为为弱电解质,二者恰好反应生成强碱弱酸盐MA,溶液显示碱性,根据电荷守恒知:c(A-)<c(M+),故溶液中应一定有:c(A-)≤c(M+),故A错误;
B、若一元酸HA为强电解质,则两溶液恰好反应时溶液显示中性,根据电荷守恒知:c(A-)=c(M+);若HA为为弱电解质,二者恰好反应生成强碱弱酸盐MA,溶液显示碱性,根据电荷守恒知:c(A-)<c(M+),故不一定有c(A-)=c(M+),故B错误;
C、由于两者恰好完全反应,若MA不水解,为强酸强碱盐,则溶液呈中性,故应有c(OH-)=c(H+),故C错误;
D、由于两者恰好完全反应,若MA水解,则为弱酸强碱盐,则溶液呈碱性,故应有c(OH-)>c(H+),故D正确.
故选D.
B、若一元酸HA为强电解质,则两溶液恰好反应时溶液显示中性,根据电荷守恒知:c(A-)=c(M+);若HA为为弱电解质,二者恰好反应生成强碱弱酸盐MA,溶液显示碱性,根据电荷守恒知:c(A-)<c(M+),故不一定有c(A-)=c(M+),故B错误;
C、由于两者恰好完全反应,若MA不水解,为强酸强碱盐,则溶液呈中性,故应有c(OH-)=c(H+),故C错误;
D、由于两者恰好完全反应,若MA水解,则为弱酸强碱盐,则溶液呈碱性,故应有c(OH-)>c(H+),故D正确.
故选D.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,注意掌握判断酸碱混合液的定性判断方法,明确盐的水解原理,能够根据电荷守恒、盐的水解原理等知识判断溶液中各离子浓度大小.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
下列说法中不正确的是( )
| A、分子式为C4Hl0O并能与金属钠反应放出氢气的有机化合物有5种 |
| B、可以用酸性高锰酸钾溶液区分苯和甲苯 |
C、 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 |
| D、可用氢氧化钠溶液、银氨溶液和碘水检验淀粉溶液是否是部分发生水解 |
在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A、υ(A)=0.5 mol/(L?s) |
| B、υ(B)=0.3 mol/(L?s) |
| C、υ(C)=18 mol/(L?min) |
| D、υ(D)=1 mol/(L?s) |
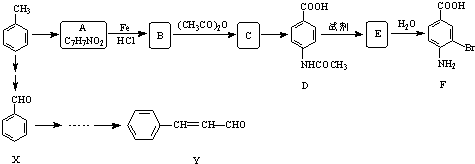
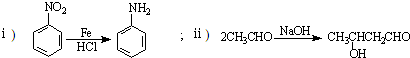
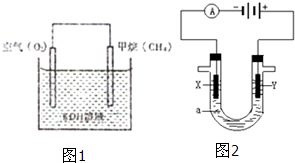 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.