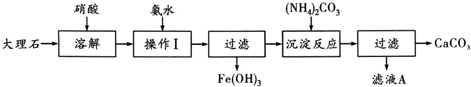
题目内容
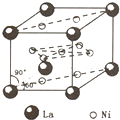 氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(
氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(139 57 |
59 28 |
(1)该合金的化学式是
(2)下列关于该贮氢材料及氢气的说法中,正确的是
A、该材料中镧原子和镍原子之间存在化学键,是原子晶体
B、氢分子被吸收时首先会在合金表面解离变成氢原子,同时放出热量
C、该材料贮氢时采用常温高压比采用常温常压更好
D、氢气很难液化是因为其分子间作用力很强
(3)某研究性学习小组查阅了有关镍及其化合物的性质资料如下:
Ⅰ、镍常见化合价为+2、+3,在水溶液中只以+2价Ni2+形式存在,+3价的Ni3+离子具有很强的氧化性.
Ⅱ、在Ni2+的溶液中加入强碱时,会生成Ni(OH)2沉淀,在强碱性条件下,该沉淀可以被较强的氧化剂(如NaClO)氧化为黑色难溶物质NiO(OH).
Ⅲ、镍易形成各种配合物,如Ni(CO)6、[Ni(NH3)6]2+等.
①写出Ni原子的基态核外电子排布式
②写出将NiO(OH)溶于浓盐酸的离子方程式
③Ni(OH)2也可以溶于氨水,写出反应的化学方程式
考点:晶胞的计算,原子核外电子排布,配合物的成键情况
专题:
分析:(1)利用均摊法计算;
(2)A.镧和镍都是金属,为金属晶体;
B.根据储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6判断;
C.根据压强对平衡移动影响分析;
D.氢气分子摩尔质量小,分子间作用力较弱;
(3)①Ni是28号元素,其核外有28个电子,Ni3+核外25个电子,根据构造原理书写其价电子排布式;
②NiO(OH)和浓盐酸发生氧化还原反应生成氯气;
③Ni(OH)2溶于氨水,生成[Ni(NH3)6]2+离子.
(2)A.镧和镍都是金属,为金属晶体;
B.根据储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6判断;
C.根据压强对平衡移动影响分析;
D.氢气分子摩尔质量小,分子间作用力较弱;
(3)①Ni是28号元素,其核外有28个电子,Ni3+核外25个电子,根据构造原理书写其价电子排布式;
②NiO(OH)和浓盐酸发生氧化还原反应生成氯气;
③Ni(OH)2溶于氨水,生成[Ni(NH3)6]2+离子.
解答:
解:(1)镍原子除一个在中心外,其他都在面上,Ni数目为1+8×
=5,镧原子在顶点上,La数目为8×
=1,故该合金的化学式是LaNi5(或Ni5La),故答案为:LaNi5(或Ni5La);
(2)(4)A.镧和镍都是金属,贮氢材料为金属晶体,故A错误;
B.根据储氢原理可知,镧镍合金先吸附H2,然后H2解离为原子,该过程用吸收热量,故B错误;
C.吸附氢气的过程为气体体积减小的反应,高压比采用常压更有利于氢气吸收,故C正确;
D.氢气分子摩尔质量小,分子间作用力较弱,故D错误;
故答案为:C;
(3)①Ni是28号元素,其核外有28个电子,根据构造原理知,Ni原子的基态核外电子排布式为[Ar]3d84s2(或1s22s22p63s23p63d84s2),故答案为)[Ar]3d84s2(或1s22s22p63s23p63d84s2);
②NiO(OH)和浓盐酸发生氧化还原反应生成氯气、氯化镍和水,离子反应方程式为2NiO(OH)+6H++2Cl-=2Ni2++Cl2↑+4H2O,故答案为:2NiO(OH)+6H++2Cl-=2Ni2++Cl2↑+4H2O;
③Ni(OH)2也可以溶于氨水,生成[Ni(NH3)6]2+离子,反应的化学方程式为Ni(OH)2+6NH3?H2O=[Ni(NH3)6]2++2OH-+6H2O,故答案为:Ni(OH)2+6NH3?H2O=[Ni(NH3)6]2++2OH-+6H2O.
| 1 |
| 2 |
| 1 |
| 8 |
(2)(4)A.镧和镍都是金属,贮氢材料为金属晶体,故A错误;
B.根据储氢原理可知,镧镍合金先吸附H2,然后H2解离为原子,该过程用吸收热量,故B错误;
C.吸附氢气的过程为气体体积减小的反应,高压比采用常压更有利于氢气吸收,故C正确;
D.氢气分子摩尔质量小,分子间作用力较弱,故D错误;
故答案为:C;
(3)①Ni是28号元素,其核外有28个电子,根据构造原理知,Ni原子的基态核外电子排布式为[Ar]3d84s2(或1s22s22p63s23p63d84s2),故答案为)[Ar]3d84s2(或1s22s22p63s23p63d84s2);
②NiO(OH)和浓盐酸发生氧化还原反应生成氯气、氯化镍和水,离子反应方程式为2NiO(OH)+6H++2Cl-=2Ni2++Cl2↑+4H2O,故答案为:2NiO(OH)+6H++2Cl-=2Ni2++Cl2↑+4H2O;
③Ni(OH)2也可以溶于氨水,生成[Ni(NH3)6]2+离子,反应的化学方程式为Ni(OH)2+6NH3?H2O=[Ni(NH3)6]2++2OH-+6H2O,故答案为:Ni(OH)2+6NH3?H2O=[Ni(NH3)6]2++2OH-+6H2O.
点评:本题考查了物质结构和性质,涉及核外电子排布式的书写、晶胞的计算,根据结构、电子排布式的书写规则、晶胞均摊法来分析解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在无色透明的溶液中可以大量共存的离子组是( )
| A、Mg2+、K+、Cl-、NO3- |
| B、H+、K+、HCO3-、NO3- |
| C、Cu2+、NO3-、SO42-、Cl- |
| D、OH-、Cl-、Na+、Al3+ |
A、B的转化率随其物质的量之比的变化曲线如图所示,该反应可能是( )


| A、A+B?C |
| B、3A+2B?2C |
| C、3A+B?2C |
| D、A+3B?C |
2.1g平均相对分子质量为7.2的CO和H2组成混合气体与足量O2充分燃烧后立即通入足量的Na2O2中,固体质量增加( )
| A、2.1g | B、3.6g |
| C、7.2g | D、不可求 |
下列物质属于电解质的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸⑧NH3?H2O ⑨三氧化硫.
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸⑧NH3?H2O ⑨三氧化硫.
| A、①②⑥⑧ | B、②⑤⑦⑧ |
| C、②⑤⑥⑦ | D、②④⑤⑨ |
 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.