题目内容
5.下列试剂保存的方法中不是从氧化还原反应角度考虑的是( )| A. | 钠保存在石蜡油或煤油中 | |
| B. | 氯水保存在棕色的试剂瓶中 | |
| C. | 保存FeCl2溶液需加入少量铁粉 | |
| D. | 盛装NaOH溶液的试剂瓶不能用玻璃塞 |
分析 A.钠能与空气中的水和氧气发生还原反应反应;
B.氯水见光会分解,发生氧化还原反应;
C.FeCl2容易被空气中的氧气所氧化,发生氧化还原反应;
D.二氧化硅能和氢氧化钠溶液反应生成黏性的硅酸钠溶液,发生复分解反应.
解答 解:A.钠能与空气中的水和氧气发生还原反应反应,故钠保存在石蜡油或煤油中,故A正确;
B.氯水见光会分解,发生氧化还原反应,故氯水保存在棕色的试剂瓶中,故B正确;
C.FeCl2容易被空气中的氧气所氧化,发生氧化还原反应,故保存FeCl2溶液需加入少量铁粉,故C正确;
D.二氧化硅能和氢氧化钠溶液反应生成黏性的硅酸钠溶液,发生复分解反应,故D错误,
故选D.
点评 本题考查了化学试剂的存放,题目难度不大,需要掌握常见试剂的保存方法,关键是掌握试剂的性质,关键化学性质选择保存方法,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
11.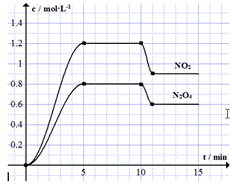 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)△H<0
②2NO2(g)?N2O4(g)△H<0.
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡.下列说法正确的是( )
 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)△H<0
②2NO2(g)?N2O4(g)△H<0.
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡.下列说法正确的是( )
| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
16.我国发射的“神州”五号载入飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑△H<0.关于该反应的叙述不正确的是( )
| A. | 该反应属于分解反应、放热反应 | |
| B. | 该反应瞬间能产生大量高温气体,推动飞船飞行 | |
| C. | 该反应把化学能转变为热能和动能 | |
| D. | 该反应反应物的总能量小于生成物的总能量 |
13.如表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
| 选项 | A | B | C | D |
| 物质 | CaCl2 | H2O2 | AlCl3 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
20.利用分液漏斗可以分离的一组混合物是( )
| A. | 溴和四氯化碳 | B. | 乙醇和乙酸 | C. | 硝基苯和水 | D. | 溴苯和苯 |
10.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 苯(苯酚):加浓溴水,静置后,过滤 |
17.检验某牙膏中不溶于水的成分是否含有Al(OH)3,可采用的方法是( )
| A. | 取滤渣加入稀氨水中,不能溶解 | |
| B. | 取滤渣加入NaOH溶液中,能溶解 | |
| C. | 取滤渣加入稀盐酸中,能溶解 | |
| D. | 将滤渣平分成两等份,分别加入NaOH溶液和稀盐酸中,均能溶解 |
14.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm-、Cn-具有相同的电子层结构,且n<m,则下列关系正确的是( )
| A. | a>b>c | B. | b>a>c | C. | a=b+m+n | D. | a=c-n-m |
 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:

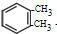 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$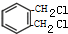 +2HCl.
+2HCl. .
. 、
、 、
、 等,所有这些同分异构体中,有6种化学环境的氢原子.
等,所有这些同分异构体中,有6种化学环境的氢原子.