题目内容
14.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm-、Cn-具有相同的电子层结构,且n<m,则下列关系正确的是( )| A. | a>b>c | B. | b>a>c | C. | a=b+m+n | D. | a=c-n-m |
分析 A、B、C三种元素的原子序数依次为a、b、c,离子An+、Bm-、Cn-具有相同的电子层结构,则核外电子数目相等,即a-n=b+m=c+n.
解答 解:A、B、C三种元素的原子序数依次为a、b、c,离子An+、Bm-、Cn-具有相同的电子层结构,则核外电子数目相等,即a-n=b+m=c+n,则a=b+m+n=c+2n,由于m>n,故b>a>c,故ABD错误,C正确,
故选C.
点评 本题考查微粒结构,题目难度不大涉及离子核电荷数与核外电子数之间的关系,侧重对基础知识的巩固.

练习册系列答案
相关题目
4.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
①预测元素周期表中,X值最小的元素位置和名称:第六周期第IA族,铯(放射性元素除外).
②根据表中的所给数据分析,同周期内的不同元素X的值变化的规律是随着原子序数的增大而增大
通过分析X值变化规律,确定P、Mg 的X值范围:1.7<X(P)<2.3,1.5<X(Mg)<0.9.
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3、Al2O3中形成的化学键的类型分别为共价键、离子键(填离子键或共价键)
④根据所学分子的立体构型和杂化方式来填写下列表格
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.5 | 1.7 | 2.3 | 3.0 | 0.8 |
①预测元素周期表中,X值最小的元素位置和名称:第六周期第IA族,铯(放射性元素除外).
②根据表中的所给数据分析,同周期内的不同元素X的值变化的规律是随着原子序数的增大而增大
通过分析X值变化规律,确定P、Mg 的X值范围:1.7<X(P)<2.3,1.5<X(Mg)<0.9.
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3、Al2O3中形成的化学键的类型分别为共价键、离子键(填离子键或共价键)
④根据所学分子的立体构型和杂化方式来填写下列表格
| 微粒 | BeCl2 | H2S | NH3 | CO32- | BF3 |
| 中心原子杂化方式 | |||||
| 微粒的空间构型 |
5.下列试剂保存的方法中不是从氧化还原反应角度考虑的是( )
| A. | 钠保存在石蜡油或煤油中 | |
| B. | 氯水保存在棕色的试剂瓶中 | |
| C. | 保存FeCl2溶液需加入少量铁粉 | |
| D. | 盛装NaOH溶液的试剂瓶不能用玻璃塞 |
9.砹(At)与F、Cl、Br、I同主族,推测砹AA或砹的化合物不可能具有的性质是( )
| A. | 砹单质是有色固体 | |
| B. | 非金属性:At>I | |
| C. | HAt的稳定性比HI的弱 | |
| D. | I2可以从At的可溶性盐溶液中置换出来At2 |
3.下列说法正确的是( )
| A. | CS2分子中σ键与π键的数目之比是2:1 | |
| B. | 分子中含有非极性键,该分子一定是非极性分子 | |
| C. | NaOH是含有非极性共价键的离子化合物 | |
| D. | 在元素周期表中,d区和ds区的元素都是金属元素 |
4.下列说法不正确的是( )
| A. | 分子式为C3H8与C9H20的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 分子组成相关一个或几个CH2原子团的化合物必定互为同系物 |

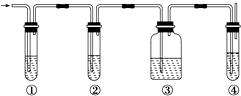 有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2.
有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2.