题目内容
17.下列对元素性质递变规律描述正确的是( )| A. | Li、Na、K元素的金属性依次减弱 | |
| B. | P、S、Cl元素的最高正价依次降低 | |
| C. | Li、Be、B的原子最外层电子数依次减少 | |
| D. | Na+、Mg2+、Al3+的离子半径依次减少 |
分析 A.同一主族元素,元素的金属性随着原子序数增大而增强;
B.第三周期主族元素,其最高正化合价与其族序数相等;
C.主族元素,其最外层电子数与其族序数相等;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:A.同一主族元素,元素的金属性随着原子序数增大而增强,这三种元素位于同一主族,且原子序数K>Na>Li,所以Li、Na、K元素的金属性依次增强,故A错误;
B.第三周期主族元素,其最高正化合价与其族序数相等,P、S、Cl元素族序数分别是5、6、7,所以P、S、Cl元素的最高正价依次升高,故B错误;
C.主族元素,其最外层电子数与其族序数相等,Li、Be、B的原子最外层电子数依次增加,故C错误;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,Na+、Mg2+、Al3+的离子半径依次减少,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,侧重考查学生分析判断能力,明确同一周期、同一主族元素原子结构、元素性质递变规律是解本题关键,注意规律中的反常现象.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
7.下列卤代烃能发生消去反应且消去产物唯一的是( )
| A. | CH3CH2CH2Br | B. | (CH3)3CCH2Br | C. | 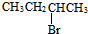 | D. | 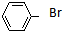 |
8.下列说法中正确的是( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 化学反应中1mol金属镁变成镁离子时得到电子数目为2NA | |
| C. | 有一种黄绿色气体,用湿润的淀粉KI试纸检测时,变蓝说明是氯气 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
5.下列有关电解质的说法不正确的是( )
| A. | K+、Mg2+、I-、NO3-在无色溶液中能大量共存 | |
| B. | K+、Na+、CO32-、NO3-在酸性溶液中不能大量共存 | |
| C. | CO2与少量烧碱溶液反应:CO2+2OH-=CO32-+H2O | |
| D. | 向AlCl3溶液中加入过量的氨水溶液Al3++3NH3.H2O=Al(OH)3↓+3NH4+ |
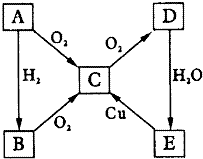 如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:
如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题: A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.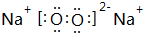 ,CB2的电子式 为
,CB2的电子式 为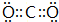 .
.



 .
.